En
1801, J A Chaptal écrit: " le principe sucré existe dans le moût et en
fait l'un des principaux caractère, il disparaît par la fermentation et
est remplacé par l'alcool qui caractérise essentiellement le vin." Le
sucre mentionné est du glucose contenu dans le jus de raisin, de
formule brute C6H12O6 qui, sous
l'action des levures de la peau de raisin, se transforme en éthanol.
Cette réaction dite fermentation alcoolique, produit également du
dioxyde de carbone.
|
|
Représenter la formule topologique de l'éthanol de formule brute C2H6O.

Quelle est la classe de l'éthanol ?
L'éthanol est un alcool primaire.
Ecrire l'équation de la réaction de formation de l'éthanol lors de la fermentation alcoolique du glucose.
C6H12O6 ---> 2C2H6O + 2CO2(g)
Plus
loin Chaptal précise " Comme le but et l'effet de la fermentation
spiritueuse se réduisent à produire de l'alcool, en décomposant le
principe sucré, il s'ensuit que la formation de l'un est toujours en
proportion de la destruction de l'autre [...] c'est pour cela qu'on
augmente à volonté la quantité d'alcool, en ajoutant du sucre au moût
qui paraît en manquer". Cette méthode d'ajout de sucre a gardé
son nom, la chaptalisation ; elle est utilisé depuis la fin du XVIIIe siècle.
Le sucre utilisé pour la chaptalisation est le saccharose de formule de brute C12H22O11.
L’équation de la réaction de transformation du saccharose en éthanol
s’écrit :
C12H22O11 +
H2O ---> 4 C2H6O +
4 CO2
(2)
On appelle degré
alcoolique d’un vin d°, le volume V (exprimé en mL) d'éthanol pur présent
dans 100 mL de ce vin. Par exemple, lorsque d° = 7, cela veut dire que dans 100 mL de vin, il y a
7 mL d’éthanol pur.
On s’intéresse à la quantité de saccharose à ajouter pour augmenter le
degré alcoolique d’un vin.
Données :
Masse
volumique de l’éthanol r = 0,79 g.mL-1 ;
Masses
molaires moléculaires : M(éthanol) = 46 g/mol ; M(saccharose) = 342 g/mol ; M(glucose) = 180 g/mol.
En considérant la
fermentation alcoolique à partir du saccharose comme une réaction totale,
quelle est la relation liant la quantité de matière de saccharose initiale
notée nsaccharose à la
quantité de matière finale d’éthanol obtenue notée néthanol ?
les nombres stoechiométriques de (2) condusent à : néthanol = 4 nsaccharose.
Montrer que la quantité de
matière d’éthanol correspondant à l’augmentation d’un degré alcoolique d’un
litre de vin est égale à 1,7×10-1
mol. En déduire la masse théorique de saccharose correspondante.
Un degré alcoolique correspond à 1 mL d'éthanol dans 100 mL de vin soit 10 mL d'éthanol dans 1 L de vin.
Soit en masse : 10*0,79 = 7,9 g ou 7,9 / M(étanol) = 7,9 / 46 = 0,171174 ~0,17 mol.
nsaccahrose =0,171174 / 4 = 0,04293 mol
msaccahrose = nsaccahrose M(saccharose) = 0,04293 * 342 =14,7 ~15 g.
|
.
Peut-on chaptaliser le muscadet ?
Dans l’appellation muscadet, la chaptalisation est autorisée
si la teneur en glucose du moût est inférieure à 161 g.L-1. Pour savoir s’il est possible légalement d’ajouter du
saccharose dans le moût de ce vin, il est nécessaire de doser le glucose qu’il
contient.
Principe du
dosage : On oxyde, à chaud et en milieu basique, le glucose par
l'acide 3,5-dinitrosalycilique (DNS), espèce chimique incolore. Cette
réaction produit l'acide 3-amino-5-nitrosalicylique qui est un composé rouge. Une
fois la réaction avec le DNS terminée, l’acide 3-amino-5-nitrosalicylique formé
est dosé par spectrophotométrie visible. Cette réaction étant totale et le DNS
étant en excès, la quantité d’acide formé est proportionnelle à la quantité de
glucose oxydé.
Protocole du
dosage :
Étape 1 : à partir d’une solution mère de
glucose de concentration molaire Cglucose
= 1,0×10-2 mol.L-1
et d’une solution contenant le DNS, un groupe d’élèves prépare cinq solutions
dont ils mesurent les absorbances, une fois la réaction d’oxydation achevée.
Les volumes utilisés pour préparer ces solutions et les valeurs des absorbances
mesurées sont indiqués dans le tableau ci-dessous.
Solution
|
1
|
2
|
3
|
4
|
5
|
Volume de la solution mère ( mL)
|
0
|
0,30
|
0,60
|
0,90
|
1,20
|
Volume du réactif contenant le DNS( mL)
|
2,0
|
2,0
|
2,0
|
2,0
|
2,0
|
Volume d'eau distillée ( mL)
|
3,0
|
2,7
|
2,4
|
2,1
|
1,8
|
Absorbance A
|
0
|
0,25
|
0,51
|
0,74
|
1,1
|
Étape 2 : le groupe d’élèves prépare une
solution X à partir d’une solution de moût du raisin Muscadet que l’on a dilué
50 fois. Les volumes utilisés pour préparer cette solution et la valeur de
l’absorbance mesurée sont indiqués dans le tableau ci-dessous.
Solution
|
X
|
Volume du moût de raisin dilué ( mL)
|
0,40
|
Volume du réactif contenant le DNS
|
2,0
|
Volume d'eau utilisé ( mL)
|
2,6
|
Absorbance
|
0,67
|
.
Exploitation :
Pourquoi a-t-on dilué le
moût avant de préparer la solution X ?
Le moût de raisin est trop concentré : l'absorbance de la solution X doit appartenir à la gamme étalon ( échelle de teintes ).
Est-il possible de
rajouter du saccharose dans le moût du raisin de Muscadet dans le respect de la
règlementation ?
On attend pour cette question
l’explicitation détaillée du raisonnement, les calculs et une conclusion.
Solution
|
1
|
2
|
3
|
4
|
5
|
Concentration en glucose ( mmol/L) : C = Cglucose * volume solution mère / 5
|
0
|
0,01 *0,30 / 5 =6,0 10-4 mol/L = 0,60 mmol/L
|
1,2
|
1,8
|
2,4
|
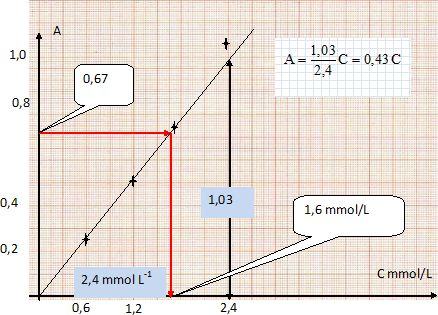
Quantité de matière en glucose : 5 10-3 * C = 5 10-3 *1,6 10-3 = 8,0 10-6 mol
Tenir compte de la dilution : 8,0 10-6 *50 =4,0 10-4 mol.
Concentration molaire du glucose dans le vin : 4,0 10-4 / (0,4 10-3 )=1,0 mol/L
Titre massique en glucose du vin : 1,0 *Mglucose = 1,0 *180 = 1,8 102 g/L.
Cette valeur est supérieure à 161 g/L, on ne peut donc pas ajouter de sucre dans le vin.
|
|
|

