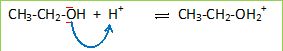Pendant
longtemps la chirurgie a été confrontée au problème de la douleur des
patients.
Ne disposant d’aucun produit permettant de la soulager, le médecin ne
pouvait
pratiquer une opération « à vif » du patient.
L'éther diéthylique était connu depuis le XVIème siècle,
mais ce n'est qu'en 1840 que William T G Morton eut l'idée de
l'utiliser afin d'endormir un patient. Et il fallu attendre l'automne
1846 pour que, dans deux amphithéatres combles, le docteur John Warren,
assisté de William Morton, réussisent deux opérations chirurgicales
indolores pour les patients. L'anesthésie venait de naître et allait
permettre l'essor rapide de la chirurgie....
|
|
Composé
|
éthanol
|
éther
diéthylique
|
eau
|
éthylène
( éthène)
|
Formule
brute
|
C2H6O
|
C4H10O |
H2O
|
C2H4
|
Température
d'ébullition ( sous 1 bar)
|
78
°C
|
25
°C
|
100°C
|
-104°C
|
Masse
molaire ( g/mol)
|
46
|
74
|
18
|
28
|
Masse volumique d’une solution aqueuse
d’hydroxyde
de sodium : r = 1,0 g.mL-1 ;
Masse
volumique de l’éthanol : réthanol
= 0,81 g.mL-1 ;
Masse
volumique de l’éther diéthylique : réther
= 0,71 g.mL-1 ;
L’eau
et l’éther ne sont pas miscibles ; la
température du laboratoire est de 20°C.
Synthèse de
l’éther
diéthylique : choix d'un protocole.
La synthèse de l’éther diéthylique peut se faire par
déshydratation de l’éthanol. Cependant selon les conditions opératoires
choisies, la déshydratation peut aboutir à deux produits différents.
Les deux équations de
réaction correspondantes sont les suivantes :
CH3-CH2-OH → CH2=CH2
+ H2O
2 CH3-CH2-OH
→
CH3-CH2-O-CH2-CH3 + H2O
La température joue un rôle important dans l’orientation de
la réaction : une température moyenne favorise la formation de
l’éther
diéthylique, une température élevée celle de l’éthylène.
Compléter
le tableau :
Conditions
opératoires
|
Température
°C
|
Nom du
produit
|
Catégorie
de la réaction
en chimie organique
|
| (1)
: vapeurs d’éthanol sur de
l’alumine |
300 |
éthylène |
élimination |
| (2)
: éthanol chauffé en
présence d’un acide
fort. |
140
|
éther
diéthylique
|
substitution
|
|
Pour
synthétiser l’éther
diéthylique, on suit le protocole expérimental suivant :
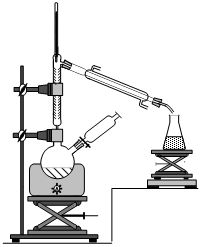
- réaliser un
montage de
distillation fractionnée dans lequel un ballon bicol supporte une
colonne à
distiller ainsi qu’une ampoule de coulée ;
- verser 25 mL
d’éthanol dans le
ballon et placer dans l’ampoule de coulée 10 mL d’un acide fort,
l’acide
sulfurique concentré ;
- sous agitation,
verser goutte
à goutte l’acide sulfurique dans le mélange, puis chauffer ;
- récupérer le
distillat lorsque
la température en tête de colonne est à 35°C ;
- verser le
distillat dans une
ampoule à décanter, ajouter une solution aqueuse d’hydroxyde de sodium
Na+(aq)
+ HO-(aq) ;
- récupérer la phase contenant l'éther diéthylique.
|
|
|
Pourquoi
faut-il mettre l’erlenmeyer de récupération du distillat dans un bain
de
glace ?
Sous une pression de 1 bar, la température d'ébullition de l'éther
diéthylique est égale à 35 °C : l'éther s'évapore facilement à la
température du laboratoire, d'où l'utilisation d'un bain de glace.
Malgré les
précautions
prises, la formation d’éthylène peut avoir lieu de façon minoritaire
mais pour
autant on ne le trouve pas dans le distillat.
À l’aide des données,
proposer une explication.
A
la température du laboratoire, à la température du bain de glace,
l'éthylène est un gaz (Tébullition = -104 °C ).
Calculer
la quantité de matière d’éthanol introduite dans le ballon et la masse
attendue
d’éther diéthylique.
m(éthanol)
= Véthanol réthanol
= 25*0,81 = 20,25 g.
n(éthanol) = m / Méthanol = 20,25 / 46 =0,4402 ~0,44 mol.
D'après les nombres stoechiométriques de l'équation n(éther) =
½n(éthanol) = 0,22 mol.
m(éther) = n(éther) Méther = 0,22 *74 =16,288 ~16 g.
Le
distillat obtenu présente un caractère acide. Quelle étape du
protocole permet
d’éliminer les traces acides du distillat ? Justifier.
"ajouter une
solution aqueuse d’hydroxyde de sodium Na+(aq)
+ HO-(aq) ".
Réaction acide base entre l'acide sulfurique et l'hydroxyde de sodium :
H3O+aq + HO-aq ---> 2H2O.
Où
se trouve l’éther diéthylique dans l’ampoule à décanter ? Justifier.
La phase aqueuse, la plus dense, occupe la partie inférieure ; la phase
éthérée, la moins dense, occupe la partie supérieure de l'ampoule à
décanter.
Etude du mécanisme de la synthèse
de l'éther diéthylique.
Le mécanisme réactionnel proposé pour la réaction de
déshydratation conduisant à l’éther diéthylique est proposé ci-dessous.
Il
comporte trois étapes.
Etape (a) : CH3-CH2-OH + H+
 CH3-CH2-OH2+ CH3-CH2-OH2+
Etape
(b) : CH3-CH2-OH2+ + CH3-CH2-OH
 CH3-CH2-OH+-CH2-CH3
+
H2O CH3-CH2-OH+-CH2-CH3
+
H2O
Etape (c) :
CH3-CH2-OH+-CH2-CH3  CH3-CH2-O-CH2-CH3 +
H+ CH3-CH2-O-CH2-CH3 +
H+
A
l’aide de vos connaissances sur les sites donneurs et accepteurs de
doublets
d’électrons, expliquer l’étape (a) du mécanisme.
L'atome d'oxygène possède deux doublets libres : il joue le rôle de
donneur d'électrons ; H+ présente un défaut
d'électrons et joue le rôle d'accepteur.
Recopier
l’équation de l’étape (a) et faire
apparaître la flèche courbe schématisant le transfert électronique.
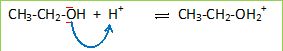
En observant les
équations
des étapes (a) et (c), justifier que
l’acide sulfurique n’est pas un réactif
dans cette synthèse. Quel peut alors être son rôle dans la synthèse ?
L'acide sulfurique apporte des ions oxonium consommé à l'étape a. Ces
ions sont régénérés à l'étape c : l'ion oxonium joue le rôle de
catalyseur et non pas celui de réactif.
Techniques
d'analyses des espèces chimiques intervenant dans la réaction.
Les
techniques utilisées sont la spectroscopie infrarouge IR
et la spectrométrie RMN du proton.
On donne
pages 8 et 9 deux spectres RMN du proton et deux
spectres infrarouge (IR) correspondant à l’éther diéthylique et à
l’éthanol
ainsi qu’une table de données de spectroscopie infrarouge IR.
| Liaison |
C-C
|
C-O
|
O-H
acide carboxylique |
C-H
|
O-H
alcool
|
| Nombre
d'onde ( cm-1) |
1000-1250
|
1050-1450
|
2500-3200
|
2800-3000
|
3200-3700
|
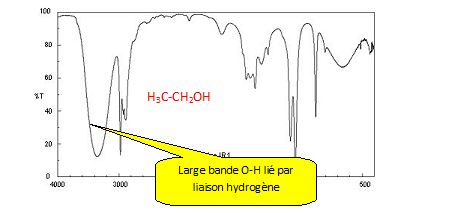
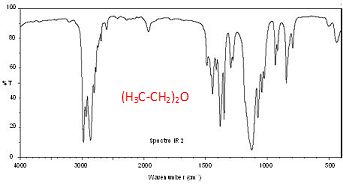
Associer
chaque spectre infrarouge IR et RMN à la molécule
correspondante en justifiant.
Attribuer
un signal RMN à chaque groupe de protons chimiquement équivalents et
justifier sa multiplicité pour chacun des signaux.
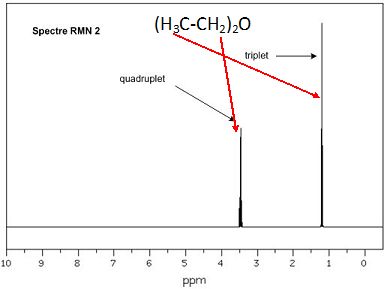
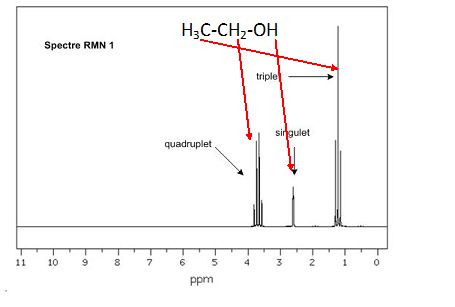 |
CH3
: ces protons équivalents ont 2 protons proches voisins, on observe un
triplet.
CH2 : ces protons équivalents ont 3 protons proches voisins,
on observe un quadruplet.
OH : ce proton n'a aucun proton proche voisin, on observe un singulet.
|
|
CH3
: ces protons équivalents ont 2 protons proches voisins, on observe un
triplet.
CH2 : ces protons équivalents ont 3 protons proches voisins,
on observe un quadruplet. |
|
|
La kétamine.
À
l’heure
actuelle, du fait de son extrême inflammabilité, de ses nombreux effets
secondaires, de sa toxicité ainsi que du risque élevé de dépendance
qu’il
entraîne, l’éther diéthylique n’est pratiquement plus utilisé comme
anesthésiant, et d’autres molécules beaucoup plus spécifiques l’ont
remplacé.
C’est le cas par exemple de la kétamine, qui contient un mélange
équimolaire
des deux molécules ci-dessous.
Reproduire la
formule
topologique de la molécule A. Entourer et identifier les groupes
caractéristiques présents dans cette molécule.
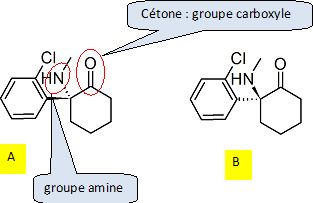
Quelle
est la différence entre les molécules A et B ?
A et B sont deux énantiomères : configuration spatiale différente
autour de l'atome de carbone asymétrique.

Du
fait de son action rapide, la kétamine est principalement
utilisée en médecine d’urgence. Elle est le plus souvent administrée
via une
injection intraveineuse unique avec une dose de l’ordre de 2 mg par kg
de corps
humain et sa demi-vie d’élimination est de 2 à 4 heures.
Par
analogie avec le temps de demi-réaction défini en
cinétique chimique, proposer une
définition au terme de « demi-vie
d’élimination » donné dans le texte.
Durée au bout de laquelle la moitié de la kétamine administrée
initialement est éliminée de l'organisme.
|
|
|