.
|
|
Charlotte
et Guillaume visitent avec leur professeur l'atelier de
conservation-restauration Arc'Antique qui est une structure
scientifique et technique ayant pour vocation la restauration et la
conservation des objets archéologiques. ce laboratoire est spécialisé
dans les travaux de restauration d'objets issus de fouilles
sous-marines.
Lors de cette visite, on explique à nos deux élèves
qu'après des siècles d'immersion, les objets se recouvrent de
concrétions marines protectrices, que l'on appelle "gangue". Le
laboratoire est justement en train de traiter des canons. Pour enlever
cette gangue, on réalise une électrolyse. On plonge le canon qui
sert de cathode dans un grand bain d'eau. On oberve alors à sa surface
un dégagement de dihydrogène qui comprime la gangue, la rendant pâteuse
et fragile. L'opération dure 700 h avec un courant électrique constant
de 7,50 A.
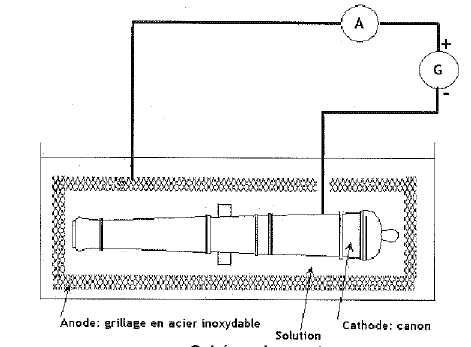
Dégangage et électrolyse de l'eau.
La réaction se produisant à la surface du canon est-elle une oxydation ou une réduction ?
Le canon est la cathode de l'électrolyseur : une réduction se produit à la cathode.
Ecrire l'équation de la réaction ayant lieu à l'anode sachant que le couple intervenant est Cl2(g) / Cl-aq.
Un oxydation se déroule à l'anode : 2 Cl-aq = Cl2(g) + 2e-.
La réaction ayant lieu à la cathode est 2H+aq + 2e- = H2(g).
Etablir une relation entre la quantité de matière n(H2) de dihydrogène dégagé est la quantité d'électrons échangés n(e-).
n(e-) = 2n(H2).
Quelle
relation existe-t-il entre la valeur absolue de la charge électrique Q,
l'intensité du courant I et la durée de l'électrolyse Dt ?
Q = I Dt.
Quelle relation existe-t-il entre la valeur absolue de la charge électrique Q, n(e-), NA et e.
Q = n(e-) NA e.
En déduire une relation entre n(H2), I, Dt, NA et e.
2n(H2) NA e = I Dt ; n(H2) = ½ I Dt / (NA e).
Calculer n(H2).
n(H2) = 0,5 *7,50 *700 *3600 / (6,02 1023 * 1,60 10-19) =98,11 ~98,1 mol.
A quel volume de H2(g) cette quantité de matière correspond-elle ? Vm = 24,0 L / mol.
V = n(H2) Vm =98,11 *24,0 = 2,35 103 L.
|
.
.
Etude de la corrosion humide.
Le
fait d'avoir restauré l'aspect du canon en retirant la gangue a pour
conséquence de le soumettre de nouveau à la corrosion. En effet, sous
l'action conjuuée du dioxygène de l'air et de l'humidité, les métaux
ferreux se recouvrent d'une couche orange-brun constituée
principalement d'oxyde de fer (III) Fe2O3. La première étape de la formation de cette rouille fait apparaître les ions ferreux Fe2+ et hydroxyde HO-.
Ecrire les demi-équations électroniques des deux couples mis en jeu Fe2+aq / Fe(s) et O2(g) / HO-aq.
Oxydation : Fe(s) = Fe2+aq + 2e-.
réduction : ½O2(g) + H2O + 2e- = 2HO-aq.
Ecrire l'équation de la réaction entre le fer et le dioxygène.
Fe(s) + ½O2(g) + H2O = Fe2+aq + 2HO-aq.
Justifier que le phénomène de corrosion se fait en milieu aqueux.
L'eau est l'un des réactifs : la corrosion se fait donc en milieu aqueux.
Protection contre la corrosion in situ.
le
personnel du laboratoire a, dans ses projets, une méthode de
conservation préventive sous-marine. Cette technique permettrait de
stocker sur une longue période les objets sans les déplacer. Elle
repose sur lapose d'une anode dite "sacrificielle " en zinc Zn(s) sur
le canon en fer qui joue alors le rôle de cathode.
Ecrire l'équation ayant lieu à l'anode sachant que le couple mis en jeu est Zn2+aq / Zn(s).
Oxydation du zinc servant d'anode : Zn(s) = Zn2+aq + 2e-.
Pourquoi utilise t-on l'adjectif " sacrificielle" pour qualifier cette électrode ?
Le zinc métallique disparaît, des ions zinc Zn2+aq apparaissent en solution. Le métal zinc est sacrifié afin que le fer soit protégé de l'oxydation.
Les seules espèces présentes susceptibles de réagir sont Fe(s), H+aq et, Cl-aq.
Quel est la seule réaction qui peut se produire à la cathode ? Justifier.
Couples oxydant / réducteur Fe2+aq / Fe(s) ; H+aq /H2(g) ; Cl2(g) / Cl-aq.
Une réduction a lieu à la cathode : un oxydant se réduit.
Fe(s) est le réducteur du couple Fe2+aq / Fe(s) ; Cl-aq est le réducteur du couple Cl2(g) / Cl-aq.
Seul, parmi les espèces citées, seul H+aq est un oxydant, espèce susceptible de se réduire.
2H+aq + 2e- = H2(g).
|
|
|