.
|
|
En
aquariophilie, on utilise comme éclairage des tubes fluorescents. Ce
type de tube contient de la vapeur de mercure à basse pression dans
laquelle on déclenche une décharge électrique. Le rayonnement
ultraviolet émis par le mercure est transformé en lumière visible par
une poudre fluorescente qui tapisse la paroi intérieure du tube. Le
spectre d’émission du tube dépend de la nature de la poudre
fluorescente utilisée.
Il existe une grande variété de tubes
fluorescents parmi lesquels on trouve des tubes avec la mention « plein
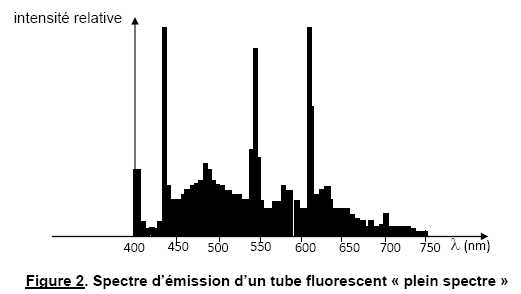
spectre » (lumière du jour). La figure suivante présente le spectre d’émission
d’un de ces tubes.
Données :
Longueurs
d’onde des principales raies d’émission du mercure dans le visible :
405 nm, 436 nm, 546 nm, 577 nm, 579 nm, 615 nm.
Constante de Planck : h = 6,63.10–34 J.s. Célérité de la lumière dans le vide : c = 3,00. 108 m.s–1.
1 eV = 1,60 10 –19 J.| couleurs | violet | bleu | vert | jaune | orange | rouge | | l (nm) | 400 - 424 | 424 - 491 | 491 - 575 | 575 - 585 | 585 - 610 | 610 - 750 |
Situer le domaine des longueurs d’onde des ultra-violets par rapport au domaine des longueurs d’onde des radiations visibles.
|
.
À propos du spectre du tube fluorescent.
Justifier l’appellation « plein spectre » de ce type de tube.
Sur la figure 2, toutes les couleurs de l'arc en ciel sont présentes avec une intensité relative non nulle.
À partir du texte, indiquer le rôle du mercure dans le tube fluorescent.
La
lumière UV du mercure excite les atomes de la poudre qui tapisse la
paroi interne du tube. Cette poudre émet alors une lumière blanche.
À propos du mercure utilisé dans le tube fluorescent.
La figure 3 ci-dessous représente le diagramme simplifié des niveaux d’énergie de l’atome de mercure.

Quel nom donne-t-on au niveau d’énergie E0 ? Comment appelle-t-on les niveaux d’énergie E1 à E4 ?
E0 : niveau fondamental, de moindre énergie ; E1 à E4 : états excités.
L’une des radiations visibles émises par la vapeur de mercure
correspond à une transition faisant intervenir les niveaux d’énergie E1
et E3 du diagramme représenté. Préciser le
sens de cette transition.
L'atome cède de l'énergie au milieu extérieur en émettant un photon.
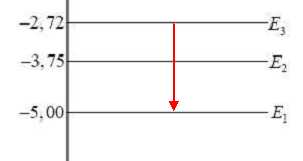
Calculer la valeur de la longueur
d’onde du photon émis lors de la transition. La valeur trouvée est-elle
cohérente avec les données de l’énoncé ?
DE = hc / l ; l = hc / DE avec DE =(5,00-2,72) *1,60 10-19 = 3,648 10-19 J.
l = 6,63 10-34 *3,00 108 / 3,648 10-19 = 5,45 10-7 m = 545 nm.
Cette valeur est cohérente avec la valeur 546 nm de l'énoncé.
|
|
|



