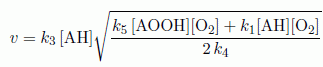|
Autour
du ß-carotène :
concours Mines 2010 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
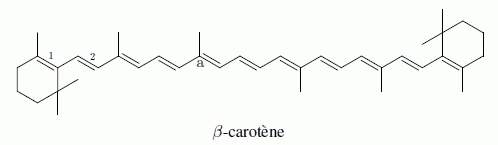 La molécule est-elle chirale ? Il n'y a pas de carbone asymétrique ; les onze doubles liaisons conjuguées sont dans le même plan : la molécule n'est pas chirale. Donner l'environnement géométrique du carbone noté " a". Ce cerbone est hybridé sp2, trois directions de liaisons. Ce carbone est du type AX2 : les 3 liaisons sont coplanaires, les angles sont proches de 120°. Donner la configuration des doubles liaisons numérotées 1 et 2. 1 et 2 : configuration E : les groupes prioritaires sont situés de part et d'autre de la double liaison. Ecrire une formule mésomère avec séparation des charges montrant la forte délocalisation des doubles liaisons. 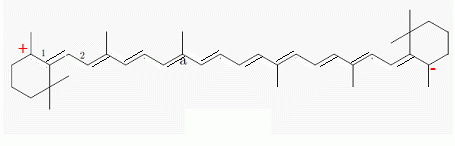 En l'absence de spectroscopie RMN, pour déterminer la structure des molécules naturelles, on utilisait des réactions chimiques pour détecter les fonctions présentes. Par exemple, la réaction d'ozonolyse découpe une grosse molécule en fragments plus petits assez facilement identifiables. Donner le bilan de la réaction d'ozonolyse en présence d'un réducteur comme le diméthylsulfure (CH3)2S sur l'exemple du propène. En présence d'un réducteur, les aldehydes formés lors de l'ozonolyse ne sont pas oxydés en acides carboxyliques. 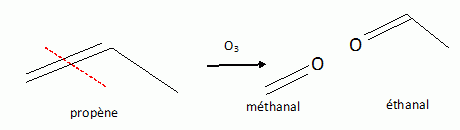
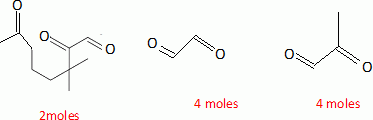
Quelles
sont les molécules obtenues à partir d'une mole de ß-carotène, ainsi
que leur proportions relatives en moles, par ozonolyse en présence d'un
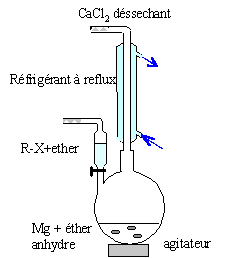
réducteur. 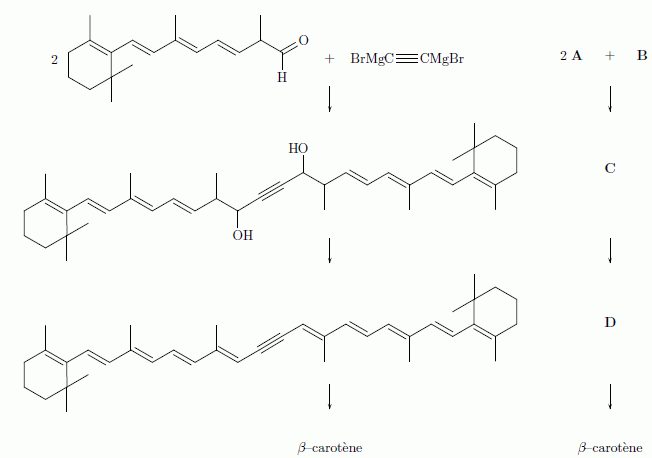 Donner les conditions expérimentales de formation du bromure d'éthylmagnésium à partir du bromoéthane. Représenter le schéma légendé du montage. Donner un exemple de solvant pouvant convenir en justifiant son choix. Solvant anhydre éther éthylique ou THF : l'eau détruit le magnésien. Le solvant est une base de Lewis : il doit être aprotique ; par ses propriétés basiques, le solvant stabilise l'organomagnésien formé.
Quelle réction se produit entre le bromure d'éthylmagnésium et l'éthanol ? Ecrire le bilan de la réaction. CH3-CH2MgBr est une base forte susceptible de réagir avec les solvants protiques et les composés à hydrogène mobile. CH3-CH2MgBr +CH3-CH2OH = CH3-CH3 + CH3-CH2OMgBr. Une réaction similaire a lieu entre deux équivalents de bromure d'éthylmagnésium et un équivalent d'acéthylène pour former B. De quel type de réaction s'agit-il ? écrire l'équation de la réaction de formation de B. Les protons acéthyléniques sont acides ; CH3-CH2MgBr est une base forte : il s'agit d'une réaction acide base. 2 CH3-CH2MgBr + HCCH = BrMgCCMgBr + 2CH3-CH3 . Deux équivalents de A réagissent avec B pour former C' qui conduit à C après hydrolyse acide. Donner la structure de C'. 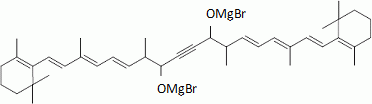 Préciser le schéma réactionnel de formation de C'. On note A sous la forme : 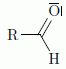 Quelle réactivité de B intervient au cours de cette réaction ? 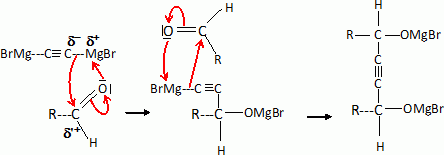 Le carbone du groupe carbonyle est électrophile ; l'organomagnésien fera une réaction d'addition nucléophile sur ce carbone. C est chauffé en milieu acide sulfurique et donne D. Comment s'appelle le passage de C à D. Justifier qu'un chauffage modéré suffit à réaliser la réaction. Déshydratation d'un alcool. Le produit de l'hydrolyse est stabilisé par résonance ( système conjugué à 11 liaisons multiple ) : un chauffage modéré suffit. Donner le schéma réactionnel sur l'un des groupements OH. Vous pouvez utiliser une représentation simplifiée. 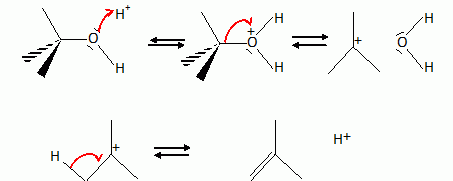 Etape 1 : protonation rapide de l'alcool ; étape 2 : formation lente du carbocation ; étape 3 : élimination d'un proton. La synthèse se termine par une hydrogénation catalytique de l'alcyne, qui forme un alcène (Z), suivie d'une isomérisation pour former le ß-carotène.
Mécanisme d'oxydation du ß-carotène. L'une des propriétés du ß-carotène est son pouvoir anti-oxydant. Il est capable de consommer le dioxygène et de prévenir la formation des radicaux libres. L'accumulation des radicaux libres dans le corps est connue pour être une source de vieillissement et peut contribuer à la formation de cancers. Plusieurs études se sont intéressées à la cinétique d'oxydation du ß-carotène par le dioxygène. l'un des mécanismes proposé est le suivant, AH représente le ß-carotène. AH + O2 --> A* +*O2H (1) constante k1. A* + O2 ---> AO2* (2) constante k2. AH + AO2* ---> AOOH + A* (3) constante k3. AO2* +AO2* ---> produits stables (4) constante k4. De quel type de mécanisme s'agit-il ? Nommer les différentes phases du mécanisme. Mécanisme radicalaire en chaine. (1) initiation ; (2) et (3) propagation ; (4) terminaison. Comment obtient-on le bilan de la réaction ? Ecrire l'équation de la réaction correspondante. (2) +(3) donnent : AH + O2 -->AOOH. On considère que la vitesse de la réaction est la vitesse de formation de AOOH. Donner l'expression de la vitesse de la réaction. v = d[AOOH] / dt = k3[AH][AO2*]. En quoi consiste l'approximation des états quasi-stationnaires ? En l'appliquant aux intermédiaires radicalaires A* et AO2*, déterminer l'expression de la vitesse de la réaction. Les intermédiaires réactionnels, très réactifs, restent en quantité pratiquement constante et très faible. d[intermédiaire] / dt =0. d[A*] / dt = 0 = k1[AH][O2] -k2[A*][O2] +k3[AH][AO2*] (5) d[AO2*]/dt = 0 = k2[A*][O2]-k3[AH][AO2*] -2k4[AO2*]2. (6) (5) + (6) donnent : k1[AH][O2] =2k4[AO2*]2. [AO2*] = [ k1 / (2k4) [AH][O2]]½. Par suite : d[AOOH] / dt = k3 [k1 / (2k4)]½[AH]1,5[O2]½. La vitesse déterminée admet-elle un ordre ? Si oui, lequel. Préciser, s'il y a lieu, l'ordre partiel par rapport à chacun des réactifs. Ordre partiel par rapport à AH : 1,5 ; ordre partiel par rapport à O2 : 0,5 La réaction est d'ordre global 2. La constante de vitesse de la réaction peut s'exprimer en fonction des constantes des actes élémentaires. Donner l'expression de k, constante de vitesse de la réaction globale, en fonction de k1, k3 et k4. k = k3 [k1 / (2k4)]½.
|
||||||||||||||||||||||||
| |
||||||||||||||||||||||||
|
|