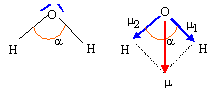|
Concours
assistant d'ingénieurs : techniques d'analyse chimique 2010
( Reims ) acide fluorhydrique, fluoroferrate (III), autour de l'élément oxygène, dilution. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
L'atome de fluor (Z=9 ) possède un seul isotope de nombre de masse 19. Indiquer la structure du noyau du nucléide. 9 protons et 19-9 = 10 neutrons. Donner la structure électronique de l'atome de fluor. 1s2 2s2 2p5. En déduire sa place ( période et colonne ) dans la classification périodique. Préciser la famille à laquelle appartient cet élément. Seconde période et 17è colonne ; famille des halogènes. Le fluorure d'hydrogène gazeux se dissout dans l'eau en toutes proportions. On donne : Na : 23 ; F : 19 g/mol ; couple acide /base HF / F- : pKa = 3,2. A 25°C, on considère une solution (A) d'acide fluorhydrique à 0,5 mol/L. Ecrire l'équation bilan de la réaction de l'eau avec le fluorure d'hydrogène. HF(g) + H2O(l) = H3O+aq + F-aq. Calculer le pH de la solution (A). On considère un litre de solution.
Ka =6,3 10-4 =[H3O+aq][F-aq] / [HF] = x2éq / (0,5-xeq) x2éq - (0,5-xeq)6,3 10-4 =0 ; x2éq + 6,3 10-4 xeq -3,15 10-4 =0 La résolution donne : xeq= 1,74 10-2 mol dans 1 L et pH = -log 1,74 10-2 =1,76. Taux d'avancement final t = xéq / xmax = 1,74 10-2/0,5 =0,035 ( 3,5 %)
On prépare une solution B en dissolvant 8 g de fluorure de sodium dans 250 mL d'eau. M(NaF) = 23+19 =42 g/mol ; n= m / M = 8 / 42 = 0,19 mol ; CB = n /V = 0,19 / 0,25 = 0,76 mol/L. Comment appelle t-on la solution C obtenue ? Quelles sont ses propriétés ? Calculer le pH de la solution C. [HF]~0,5*0,3 / (0,3+0,2) = 0,3 mol/L ; [F-] =0,76*0,2 / 0,5 =0,30 mol/L. [HF] = [F-] , donc pH=pKa = 3,2. On obtient une solution tampon. Celle-ci modère les variations de pH suite à l'ajout modérée de base forte ou d'acide fort. Le pH ne varie pas lors d'une dilution modérée. On se propose de déterminer la constante de dissociation ( Kd ) du complexe [FeF]2+. Pour cela on réalise les deux demi piles suivantes : Demi-pile n° 1 : une lame de platine plongeant dans une solution aqueuse contenant des ions Fe3+ et Fe2+ à la même concentration 1,0 10-2 mol/L pour chacune des espèces. Demi-pile n° 2 : une lame de platine plongeant dans 100 mL de solution aqueuse dans laquelle on dissout : 1,0 10-3 mol de sel de Mohr, 5,0 10-4 mol d'alun ferrique et 1,0 10-2 mol d'ions fluorure, sans variation de volume. On suppose que seul le complexe [FeF]2+est formé. Précisez le nom de ce complexe. fluoroferrate (III).. Faire un schéma annoté de la pile. Le pôle positif correspond à l'électrode n°1. 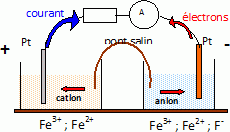 Donnez l'expression littérale du potentiel E1 de la demi-pile n°1. Calculer E1. E1 = E°(Fe3+ / Fe2+ ) + 0,06 log([Fe3+] /[Fe2+] =E°(Fe3+ / Fe2+ ) + 0,06 log 1 =E°(Fe3+ / Fe2+ ) = 0,77 V. Demi-pile n°2 : Calculer les concentrations molaires [Fe3+] et [Fe2+]avant introduction des ions fluorure. Sel de Mohr : FeSO4, (NH4)2SO4, 6H2O. [Fe2+] =1,0 10-3 / 0,10 = 1,0 10-2 mol/L. Alun ferrique Fe2(SO4)3, K2SO4, 4H2O. [Fe3+] =2* 5,0 10-4 / 0,10 = 1,0 10-2 mol/L. La fem de la pile ainsi constituée est 0,25 V. Calculer E2 et en déduire la concentration molaire en ion Fe3+ non complexé de la solution de la demi-pile n°2. 0,25 = E1-E2 ; E2 = 0,77-0,25 = 0,52 V. E2 = E°(Fe3+ / Fe2+ ) + 0,06 log([Fe3+] /[Fe2+] 0,52 = 0,77 + 0,06 log([Fe3+] /0,010) ; log([Fe3+] /0,010) = -0,25 / 0,06 =-4,17 ; [Fe3+] /0,010 =6,8 10-5 ; [Fe3+] =6,8 10-7 mol/L. Donner l'expression littérale de la constante de dissociation Kd du complexe [FeF]2+. Calculer Kd. Kd = [Fe3+][F-] / [FeF]2+]. L'ion fluorure est en large excès et la réaction de formation du complexe est supposée totale. [F-] initial=0,01/0,1 = 0,10 mol/L ; [F-]final ~0,10-0,01 = 0,09 mol/L ; [FeF]2+] ~ 1,0 10-2 mol/L. Kd =6,8 10-7 *0,09 / 0,010 = 6,1 10-6.
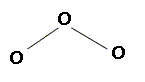
Problème 4. On représente un atome par la notation AZX A quoi correspondent A, Z, X ? A : nombre de masse, nombre de nucléons ; Z : n° atomique, nombre de charges ; X : symbole de l'élément chimique. La masse atomique de l'oxygène est 15,9994 g/mol. le pourcentage de l'isotope 17 est 0,037 %. Déterminer les pourcentages des isotopes 16 et 18. On donne : masse molaire de 16O : 15,99 491 g/mol ; masse molaire de 17O : 16,99 914 g/mol ; masse molaire de 18O : 17,99 916 g/mol. On note x le pourcentage de l'isotope 16 et 100-0,037-x =99,963-x celui de l'isotope 18. 15,9994 *100= 0,037 *16,99 914 + 15,99 491 x +17,99 916 (99,963-x) 1599,94 = 0,62 897 + 15,99 491 x +1799,25 -17,99 916 x 199,94 =2,00425 x ; x = 99,76 %. 16O : 99,76 % ; 18O : 0,205 %. A partir du nombre d'électrons externes, déduire la réactivité de l'oxygène ( Z=8 ). 6 électrons externes. L'oxygène a tendance à compléter à huit sa couche électronique externe soit en établissant deux liaisons de covalence ( H2O ) soit en gagnant deux électrons ( CaO ; Ca2+ +O2-). Prévoir à partir de la méthode VSEPR la géométrie de la molécule d'ozone O3. Ecrire les formes mésomères limites. Comparez les longueurs des liaisons dans l'ozone et dans le dioxygène. L'atome central est lié à deux autres atomes et compte un doublet non liant, d'où le type AX2E : molécule coudée plane avec un angle voisin de 120°.
m1 =
m2 ; m = 2
m1 cos
(½a) =2*5,12 10-30*cos (104,5 / 2 ))= 6,27 10-30 Cm.
|
|||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||
|
|