|
Concours
technicien de recherche ( chimiste ) 2010 ( Avignon ) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sur le flacon d’acide sulfurique 98%, il est écrit les indications suivantes : - R 35 : Cause severe burns. - S 26 : In case of contact with eyes, rinse immediately with plenty of water and seek medical advice. - S 30 : Never add water to this product. - S 45 : In case of accident or if you feel unwell, seek medical advice immediately. Quelle est la signification du pictogramme suivant :  Solution corrosive. Quelles précautions devez-vous prendre pour préparer une solution diluée de ce produit ? Lister sur votre copie toutes les précautions nécessaires. a. Vous mettez des gants. b. Vous mettez des lunettes. c. Vous mettez un masque. d. Vous travaillez sous une hôte chimique. e. Vous versez ce produit dans un bécher sec puis ajoutez de l’eau. f. Vous versez ce produit dans un bécher contenant déjà de l’eau distillée. g. Vous refusez toute manipulation compte-tenu des risques. h. Vous demandez une prime de risque. Porter une blouse, des gants et des lunettes de protection. Verser l'acide concentré dans un becher contenant déja de l'eau distillée. Indiquer parmi les composés suivants ceux qui pourraient être stockés dans la même armoire que ce produit : a. Acide nitrique 70% ; b. Mercure liquide ; c. Hydroxyde de sodium ; d. Vinaigre ; e. Saccharose ; f. Permanganate de potassium. L'acide sulfurique concentré ne doit pas être stocké avec des bases concentrées ( hydroxyde de sodium) ni avec des solutions contenant des anions oxydants ( acide nitrique 70 %, permanganate de potassium). L'acide sulfurique concentré est capable de déxhydrater le saccharose.
Le sulfate ferrique (sulfate de fer III) cristalline avec un certain nombre de molécules d’eau : On dose l’acide lactique, considéré comme le seul acide présent dans le lait étudié, par une solution d’hydroxyde de sodium : Na+ (aq) + HO- (aq) (soude) de concentration Cb = 5,00 x 10-2 mol.L-1. On prélève un volume VA = 20,0 mL de lait que l’on place dans un bécher et on suit l’évolution du pH en fonction de volume Vb de soude versé. Quelle(s) électrode(s) est ou sont nécessaire(s) à la mesure du pH d’une solution aqueuse ? Electrode combinée ou bien électrode de verre ( pour la mesure du pH) et une électrode au calomel saturée ( référence). Faire un schéma du dispositif expérimental. 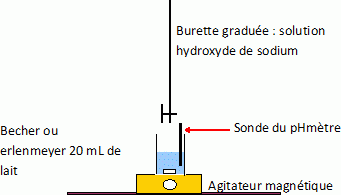 Ecrire l’équation de la réaction qui se produit lors du mélange. Quelle caractéristique doit présenter cette réaction pour être adaptée à un dosage ? AH aq + HO-aq = H2O(l) + A-aq. La réaction support d'un dosage doit être rapide et totale. Exprimer puis calculer la constante de réaction K correspondante. Conclure. Données : couple acide/base : H2O/HO-(aq) : pKa1 = 14, 0 ; H3O+(aq)/H2O : pKa2 = 0 ; HA(aq)/A-(aq) : pKa3 = 3, 9. 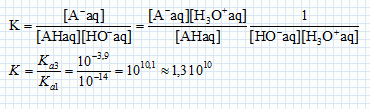 K est très grand, la réaction dans le sens direct est totale. On obtient les valeurs données dans le tableau suivant :
En utilisant un diagramme de prédominance, déterminer quelle est, entre HA et A- l’espèce chimique prédominante au début du dosage. 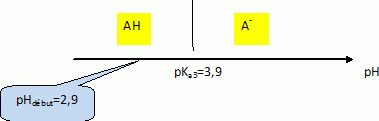 D’après le tableau de valeur pour quel volume de soude versé, HA et A- sont-elles présentes en quantité égales ? Justifiez votre réponse. à pH = pKa3 = 3,9, les concentrations de l'acide AH et de sa base conjuguée A- sont égales. On se trouve alors à la demi-équivalence du dosage. Le tracé du graphe représentant l’évolution du pH en fonction du volume de soude versé montre que l’équivalence acide base est atteinte pour un volume de soude VB = 12,0 mL. En déduire la quantité de matière d’acide lactique présente dans le volume VA de lait. A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques. n(AH = n(HO-) = VbCb = 12,0 10-3 *5,00 10-2 =6,00 10-4 mol. Il est possible de réaliser ce dosage en utilisant un indicateur coloré. Parmi les indicateurs suivants, lequel est le plus adapté (les valeurs indiquées entre parenthèses délimitent les pH de la zone de virage). Justifier votre réponse. a. Hélianthine (3,1-4,4) ; b. Rouge de méthyl (4,2-6,2) ; c. Rouge de phénol (6,8-8,4). L'intervalle de virage de l'indicateur coloré doit contenir le pH du point équivalent ( pHéq =8,0 dans ce cas ). Le rouge de phénol convient. On considère qu’un lait frais a une concentration en acide lactique inférieure à 1,8 g. L-1. Quelle est la masse d’acide lactique présente dans un litre de ce lait ? Conclure ? 6,00 10-4 mol d'acide lactique dans VA = 20 mL soit [AH] =6,00 10-4 / 20 10-3 = 0,300 mol/L soit 0,300 *90 =2,7 g/L, valeur supérieure à 1,8 g/L : le lait n'est pas frais. Donnée : masse molaire moléculaire de l’acide lactique : M(HA) = 90 g. mol-1.
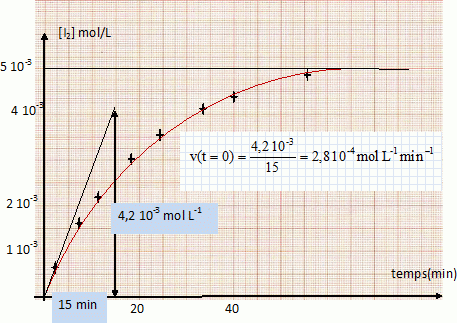
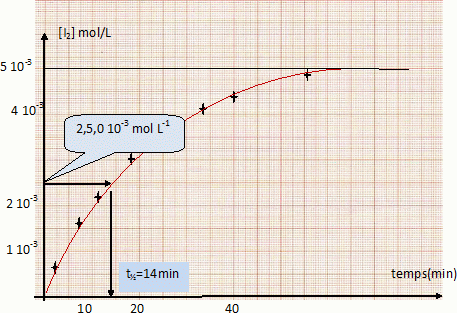
On mélange dans un bécher 100 cm3 d’une solution de concentration molaire 2.10-2 mol.L-1 d’iodure de potassium KI et 100 cm3 d’une solution de concentration molaire 10-2 mol.L-1 de peroxidisulfate de potassium K2S2O8 (réaction 1). La solution devient jaunâtre par suite de l’apparition progressive d’iode. On se propose d’étudier la vitesse de formation du diiode en fonction du temps. Pour cela, on opère des prélèvements de 10 cm3 du milieu réactionnel aux différents temps t. La réaction de formation du diiode dans les prélèvements est arrêtée par dilution dans de l’eau distillée glacée. On dose alors l’iode présent dans les prélèvements au moyen d’une solution titrée de thiosulfate de sodium Na2S2O3 de concentration molaire 0,01 mol.L-1, cette réaction de dosage étant supposée instantanée (réaction 2). Données : E° ( S2O82- / SO42- ) =2,01 V ; E° ( S4O62- / S2O32- ) =0,08 V ; E° ( I2 / I- ) =0,62 V. Ecrire les équations-bilan des réactions 1 et 2. S2O82- +2e-= 2SO42- ; 2I- = I2 +2e- . S2O82- +2I- = 2SO42- + I2 (1). 2S2O32- =S4O62- +2e- ; I2 +2e- = 2I- ; 2S2O32- + I2 = S4O62- + 2I- (2). On mesure le volume V de solution de thiosulfate de sodium versé dans chacun des prélèvements du milieu réactionnel. Etablir la relation liant la concentration molaire du diiode formé en fonction du volume V (en cm3). n(I2) =½ n(S2O32-) = 0,5 C V = 0,5*0,01 V= 5 10-3 V ( mmol) Compléter la 3è ligne du tableau suivant. [I2] = 5 10-3 V / volume prélevement = 5 10-3 V / 10 = 5 10-4 V mol/L
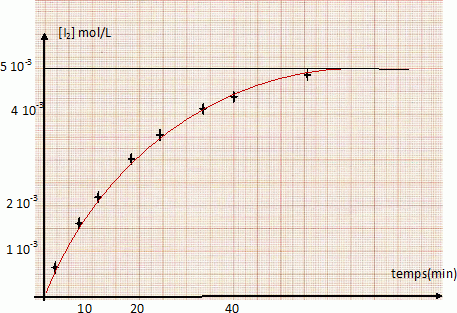
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|