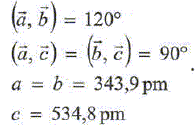|
Autour de H2S :
propriétés moléculaires, équilibre chimique, chimie des solutions :
concours
Caplp maths sciences 2011 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
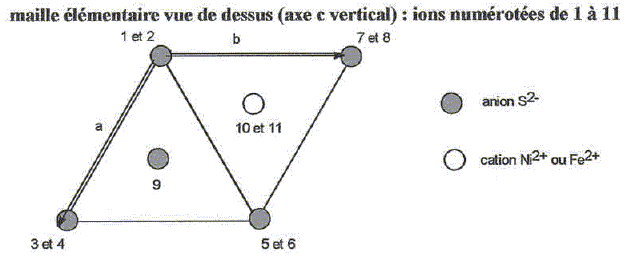
Le soufre est un élément très répandu aussi bien à l'état natif que combiné ( sulfures et sulfates ). Combiné à lhydrogène sous forme de sulfure d'hydrogène H2S(g), il est présent dans certains gisements de gaz naturel. Quelques propriétés moléculaires de H2S.
L'oxygène, le soufre et le sélénium appartiennent à la même famille du tableau périodique, les chalcogènes. Déterminer la configuration électronique fondamentale puis le nombre d'électrons de valence de l'atome S. En déduire les nombres d'électrons de valence des atomes O et Se. Atome S : 1 s2 2s2 2p6 3s2 2p4 ; 6 électrons de valence. Les éléments d'une même famille comptent le même nombre d'électrons de valence. Donner la formle de Lewis pour la molécule H2S(g) puis sa géométrie selon le modèle VSEPR. En déduire la géométrie des molécules H2O(g) et H2Se(g). 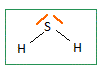 Type AX2E2, molécule coudée. Il en est de même pour H2O et H2Se. Quelle propeiété des atomes O, S et Se peut-on comparer en observant les valeurs du moment dipolaire ? L'atome d'oxygène est plus électronégatif que l'atome d'hydrogène L'atome d'oxygène est plus électronégatif que l'atome de soufre ; ce dernier est plus électronégatif que l'atome de sélénium. Justifier succinctement l'anomalie de la température d'ébullition sous 1 bar pour l'eau. L'atome d'oxygène étant bien plus électronégatif que l'atome d'hydrogène, les molécules d'eau sont associées par liaisons hydrogène intermoléculaires dans le liquide. Equilibre chimique faisant intervenir H2S. La réaction dite de Claus permet la conversion du sulfure d'hydrogène(g) en soufre en deux étapes. l'une des étapes peut être modélisée par la réaction exothermique suivante : Réaction (1) : 2H2S(g) + SO2(g) = 2H2O(g) + 3S(s). On fait réagir 3 moles de H2S(g) avec 1 mole de SO2(g) à 300 °C sous une pression constante de 1 bar. Il n'y a pas de H2O(g) et de S(s) en début de la réaction.
Déterminer
le degré d'oxydation du soufre dans H2S(g), SO2(g) et
S(s). En déduire l'espèce qui est oxydée dans la réaction 1 Expliciter K° en fonction de xéq puis calculer sa valeur si xéq = 0,813 mol.
Pressions partielles des gaz : PH2O = 2xéqP / (4 - xéq) ; PH2S= (3-2xéq) P / (4 - xéq) ; PSO2 = (1-xéq) P / (4 - xéq) avec P = 1 bar. K° = P2H2O / (P2H2S PSO2) K° = 4x2éq (4 - xéq) / ((3-2xéq)2(1-xéq)) K° =4*0,8132(4-0,813) /( (3-2*0,813)2(1-0,813))=32,8. Quelle est l'influence d'une augmentation de la température à pression constante sur l'équilibre ? Un raisonnement qualitatif est attendu. Le système réagit dans le sens d'une diminution de la contrainte imposée. La réaction dans le sens direct étant exothermique, l'équilibre est déplacé vers la gauche, sens indirect. Quelle est l'influence de l'ajout de S(s) à température et pression constante sur l'équilibre ? Le quotient initial de réaction est inchangé par l'ajout de soufre solide : on aboutira au même équilibre. La réaction 1 est catalysée par l'alumine ou le rutile TiO2(s). Qu'est ce qu'un catalyseur ? S'agit-il d'une catalyse homogène, hétèrogène ou par transfert de phase ? Un catalyseur augmente la vitesse d'une réaction. Il est régénéré lors de la dernière étape et n'apparaît pas dans le bilan Il peut orienter la réaction si deux isuues sont possibles. Le catalyseur est un solide, les réactifs sont gazeux : catalyse hétérogène. Chimie des solutions de H2S. On donne : M(Fe) = 55,8 g/mol ; M(Ni) = 58,7 g/mol ; M(S) = 32,0 g/mol.
Constantes de précipitation à 25 °C : pKs ( NiS) = 23,0 ; pKs(FeS) =18,4. Potentiel standard redox à 25 °C : E°(S4O62-aq / S2O32-aq) = 0,09 V. Le sulfure d'hydrogène est partiellement soluble dans l'eau. L'équilibre de dissolution s'écrit : H2S(g) = H2S(aq) ; K°(25°C) = 0,09. Expliciter la constante d'équilibre K° en fonction de la concentration molaire [H2S(aq)] et de la pression partielle p(H2S) de H2S(g) ? K° = [H2S(aq)] / p(H2S). Calculer [H2S(aq)] pour une solution saturée de sulfure d'hydrogène obtenue par barbotage de H2S(g) à 1 bar. [H2S(aq)] = K°p(H2S) = 0,09 mol/L. Calculer la valeur de l'enthalpie standard de la réaction à 25°C DrH°(298 K) de la réaction de dissolution de H2S(g). DrH°(298 K) =DfH°(H2S(aq)) - DfH°(H2S(g)) = -39,7 -(-20,6) = -19,1 kJ mol-1. DrH°(298 K) est négatif, la réaction de dissolution est exothermique. Calculer la valeur de l'entropie standard de la réaction à 25°C DrS°(298 K) de la réaction de dissolution de H2S(g). DrS°(298 K) =S°(H2S(aq)) - S°(H2S(g)) = 121,3 -205,7 = -84,4 J K-1 mol-1. Calculer la valeur de l'enthalpie libre standard de la réaction à 25°C DrG°(298 K) de la réaction de dissolution de H2S(g). DrG°(298 K) = DrH°(298 K) - T DrS°(298 K) = -19100 +298 *84,4 =6,05 103 kJ mol-1. Retrouver la constante d'équilibre de la réaction de dissolution. DrG°(298 K) = -RT ln K ; ln K = DrG°(298 K) /( -RT) = -6,05 103 / (8,31*298) =-2,44 ; K = 0,087.
Le sulfure d'hydrogène est un diacide H2S(aq). Construire le diagramme de prédominance des espèces sur un axe de pH.  Calculer la valeur du pH d'une solution de sulfure d'hydrogène H2S aq saturée obtenue par barbotage de H2S(g) à 1 bar. H2S(aq) +H2O(l) = H3O+aq + HS-(aq) ; Ka1 = 10-7 réaction prépondérante. HS-(aq) +H2O(l) =S2-(aq) +H3O+aq ; Ka2 =10-12,9. On note x : l'avancement volumique. Ka1 = 10-7 = x2 / (0,09-x) ; (0,09-x)10-7 = x2 ; x2 + 10-7 x -9 10-9 = 0 ; solution : x = 9,48 10-5 ; pH = - log 9,48 10-5 = 4,0. On met en solution 2,3 g d'un échantillon contenant 5 % de nickel et 15 % de fer ( composition massique ) par attaque avec un acide fort. On obtient ainsi une solution d'ions nickel Ni2+aq et de fer Fe2+aq. La solution d'attaque est introduite dans une fiole jaugée de 500 mL puis le volume est ajusté avec de l'eau distillée. On appelle S la solution obtenue. Son pH est proche de zéro. La totalité de la solution est versée dans un becher puis on fait barboter du sulfure d'hydrogène à 1 bar pour saturer continuellement la solution S en H2S(aq) et on élève le pH par ajouts progressifs de base forte concentrée ( variation de volume négligé) pour faire précipiter NiS(s) et FeS(s). La solution reste totalement saturée en H2S aq lors de l'ajout de base. Calculer la valeur de la concentration molaire en ion nickel de la solution S avant le barbotage de H2S(g) et la modification du pH. Masse de nickel : m = 2,3 *0,05 =0,115 g : n(Ni) = m/M(Ni) =0,115 / 58,7 =1,96 10-3 mol ; [Ni2+aq] = n(Ni) / volume en litre =1,96 10-3 / 0,500 =3,918 10-3 ~3,9 10-3 mol/L. Que peut-on dire sur la valeur de la concentration molaire [H2S(aq)] tout au long de cette expérience ? "on fait barboter du sulfure d'hydrogène à 1 bar pour saturer continuellement la solution S en H2S(aq)" : [H2S(aq)] = constante. Montrer que [H3O+aq]2[S2-(aq)] = 9 10-21,9. Ka1 = [HS-(aq)][H3O+aq] / [H2S(aq)] = 10-7. Ka2 = [S2-(aq)][H3O+aq] / [HS-(aq)] = 10-12,9. Ka1 Ka2 = [H3O+aq]2[S2-(aq)]/ [H2S(aq)] ; [H3O+aq]2[S2-(aq)]= Ka1 Ka2 [H2S(aq)] = 10-7 * 10-12,9 *0,09 = 9 10-21,9. La valeur du pH de début de précipitation des ion fer (II) est pH2 = 2,2. Calculer la valeur pH1 du pH de début de précipitation du sulfure de nickel. pKs ( NiS) = 23,0 ; 10-23 =[S2-(aq)] [Ni2+aq] ; [S2-(aq)] = 10-23 / 3,918 10-3 =2,552 10-21 mol/L. [H3O+aq]2[S2-(aq)]=9 10-21,9 ; [H3O+aq]2 = 9 10-21,9 / 2,552 10-21 =0,444 ; [H3O+aq] =0,666 ; pH1 = -log 0,666 =0,176 ~ 0,18. Calculer la valeur pH3 du pH pour faire précipiter 99,9 % du sulfure de nickel. [Ni2+aq]fin = (1-0,999)[Ni2+aq]initial = 10-3 *3,918 10-3 =3,918 10-6 mol/L. [S2-(aq)] = 10-23 / 3,918 10-6 =2,552 10-18 mol/L. [H3O+aq]2 = 9 10-21,9 / 2,552 10-18 =4,44 10-4 ; [H3O+aq] =2,11 10-2 ; pH3 = -log 2,11 10-2 =1,676 ~ 1,7. On réalise ainsi la précipitation sélective des sulfures de nickel et de fer. L'ion nickel est entièrement précipité sous forme de sulfure de nickel avant le début de la précipitation du sulfure de fer.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|