|
Synthèse du zirconon, détermination de la structure d'un composé aromatique : bac STL chimie de laboratoire 2011. |
|||||||
|
|||||||
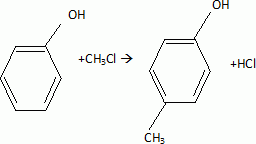
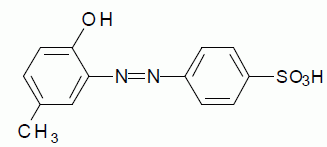 Le zirconon est obtenu par réaction de copulation diazoïque de deux composés notés B et I. La synthèse de B est schématisée par la suite réactionnelle suivante : 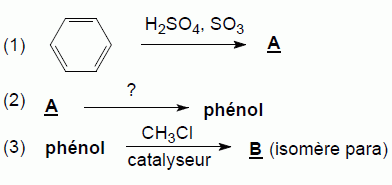 Écrire la formule semi-développée de A.Nommer A. 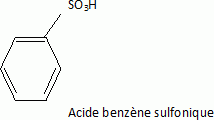 Indiquer comment transformer A en phénol (réactifs, conditions opératoires). Préciser le nom du procédé utilisé. Fusion alcaline ( NaOH) des acides benzène sulfoniques vers 400°C, suivie de l'ajout d'acide chlorhydrique.
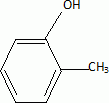 Donner la nature de l’électrophile mis en jeu dans cette transformation. CH3+ , carbocation méthyle. Nommer B. 4-méthylphénol. La synthèse de I est schématisée par la suite réactionnelle : 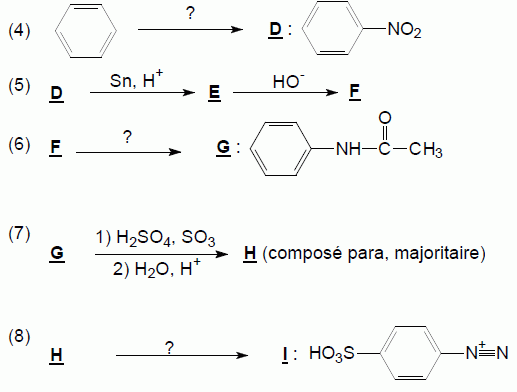 Préciser les conditions opératoires pour l'étape 4. Nitration du benzène en présence d'acide sulfurique et d'acide nitrique concentré à 50°C. 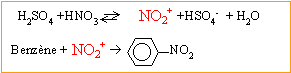
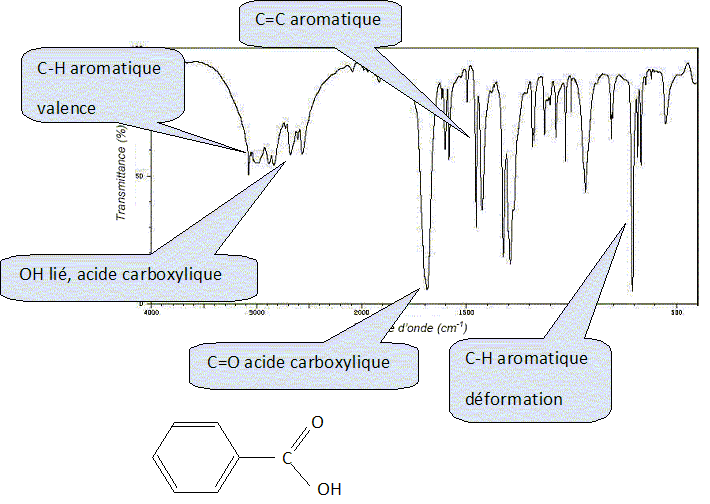
Donner les formules semi-développées de E et F. 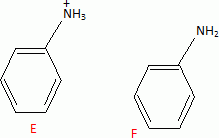 Écrire l’équation de la réaction traduisant le passage de D à E sachant qu’au cours de la transformation, l’étain est oxydé en ion Sn4+. Les demi-équations électroniques sont demandées. 3 fois { Sn(s) = Sn4+aq + 4e- } 2 fois { C6H5NO2 +7H+ + 6 e- = C6H5NH3+ +2H2O } 2C6H5NO2 +14H+ + 3 Sn(s) = 2 C6H5NH3+ +4H2O +3 Sn4+aq. Proposer un réactif (nom et formule) pour réaliser l'étape 6. Nommer G. Chlorure d'éthanoyle CH3-COCl ; G est la N-phényléthanamide. Donner la formule semi-développée de H. 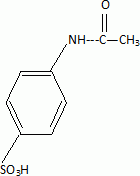 Préciser le nom de la réaction conduisant à I. Diazotation. Écrire l’équation de la réaction de B avec I conduisant à la formation du zirconon. 
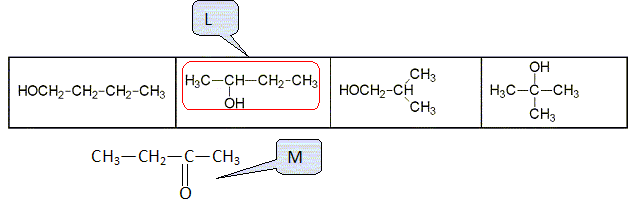
Donner l’équation de la réaction correspondant au test 3. C2H5-CO-CH3 + 3I2 + 4OH- --> C2H5-COO- + CHI3 solide + 3I- + 3H2O L existe sous la forme de deux énantiomères. Dessiner en représentation de Cram un des deux énantiomères. Indiquer la configuration absolue de l’atome de carbone asymétrique dans la molécule représentée : justifier la réponse en expliquant la démarche suivie. 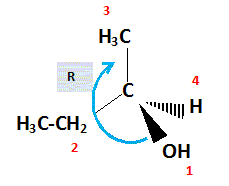 Structure de J. On peut synthétiser J en faisant réagir K avec L en milieu acide et en chauffant. Écrire l’équation de la réaction en donnant la formule semi-développée de J. 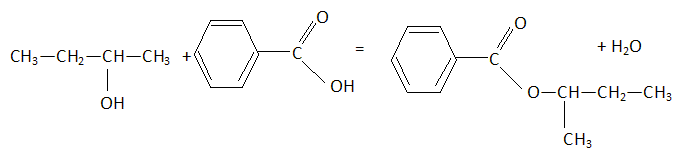 Donner les caractéristiques cinétiques et thermodynamiques de cette transformation. Estérification lente, limitée par l'hydrolyse de l'ester J. J peut être également obtenu en faisant réagir L sur le chlorure de benzoyle. Écrire l’équation de cette réaction. 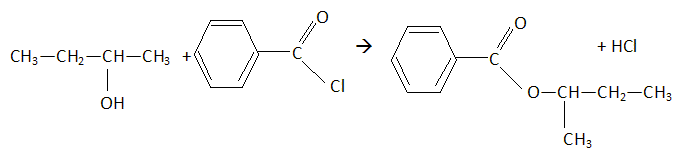 Indiquer l’intérêt de cette méthode de synthèse par rapport à la précédente. En absence d'eau, l'ester ne subit pas d'hydrolyse. Avec le chlorure de benzoyle, la réaction est totale. |
|||||||
|
|