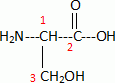Le temps de réaction est la durée écoulée entre
l'instant où un conducteur voit un obstacle et l'instant où il appuie
sur la pédale de frein. Le temps de réaction normal est environ égal à
une seconde. La consommation d'alcool augmente le temps de réaction.
Dès 0,5 g d'alcool par litre de sang, le temps de réaction peut
atteindre 1,5 s.
A 90 km/h
soit 25 m/s, quelle sera en mètre, la distance parcourue en une
seconde, en 1,5 seconde ?
d(m) = v(m/s) t (s) ; d1 = 25*1 = 25 m ; d2
= 25*1,5 = 37,5 ~38
m.
Un véhicule se déplace sur une route droite et horizontale. Le véhicule
commence à freiner en un point A et s'arrête en un point B. Lors du
freinage le véhicule est soumis à trois forces : son poids P, la
réaction normale de la route, la force f de freinage.
Expliquer
pourquoi les schémas 2 et 3 sont incorrects.
(2) la force de freinage a le même sens que le déplacement.
(3) : le poids n'est pas vertical.
|
|
Etude
énergétique.
Pourquoi
les travaux du poids et de la réaction normale de la route sont-ils
nuls ? ( schéma 1)
Une force perpendiculaire au déplacement ne travaille pas.
Donner l'unité du
travail d'une force.
Le joule (J).
La
masse de la voiture est m = 1200 kg. Au point A, la vitesse du véhicule
est vA =25 m/s.
Montrer que le
véhicule possède une énergie cinétique Ec(A) = 3,75 105
J.
Ec(A) =½mv2A =
0,5*1200*252 = 3,75 105 J.
L'énergie
cinétique en B est nulle, car le véhicule est arrêté.
Calculer le travail
W de la force de freinage sur le trajet AB.
Ecrire le théorème de l'énergie cinétique entre A et B : seule la force
de freinage travaille.
½mv2B-½mv2A = W ; 0-½mv2A =
W ; W = -3,75 105 J.
Les
premiers soins.
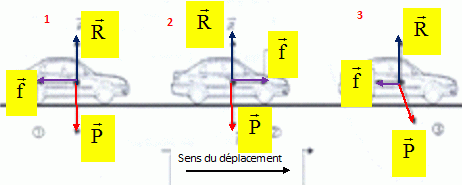
Au cours d'un accident, on doit injecter un liquide par perfusion à un
blessé. On donne la masse volumique du liquide à injecter r = 1050 kg m-3.
|
La loi de
la statique des fluides est DP
= PB-PA = r
g h avec g = 9,81 S.I.
Montrer que DP = 1,54 104 Pa. On donne h
= 1,5 m.
DP =1050*9,81 *1,5 =1,54 104
Pa.
Calculer PB
. On donne PA =1,013 105 Pa.
PB=PA
+ DP = 1,013 105 + 1,54 104
=1,1675 105 ~1,17 105 Pa.
La
pression sanguine du blessé doit-elle être égale, supérieure,
inférieure à PB ?
Le liquide à perfuser peut pénétrer dans la veine si la pression PB
est supérieure à la pression sanguine.
La poche de volume0,50L, contenant le liquide à perfuser doit s'écouler
en 20 minutes.
Calculer le débit de
cette perfusion dans l'unité de votre choix.
Débit (L/min) = volume (L) / durée (min) = 0,5 / 20 = 2,5 10-2 L /min.
Nature
du liquide perfusé : polypeptides.
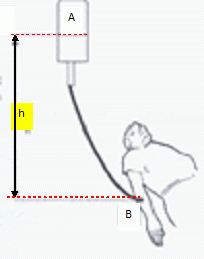
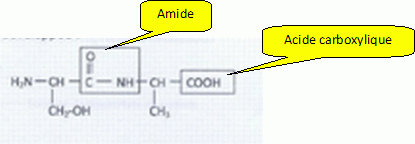
On s'interesse à un dipeptide, la sérine alanine ( Ser-Ala).
Nommer les groupes
caractéristiques encadrés.
L'hydrolyse de ce dipeptide permet d'obtenir deux acides a-aminés dont la sérine de formule
:
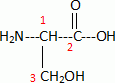
parmi les
atomes de carbone numérotés 1, 2, 3, retrouver le ou les atome(s) de
carbone asymétriqu(s).
L'atome de carbone 1 est asymétrique : il est tétragonal
et lié à 4 atomes ou groupes d'atomes différents.
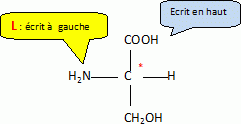
Donner la
représentation de Fischer de la sérine en configuration L.
Compléter
l'équation de l'hydrolyse du dipeptide Ser-Ala.

Antiseptique.
La bétadine est un antiseptique à base de diiode à 4%. La concentration molaire en diiode ( I2) de cette solution est de l'ordre de 1,7 10-2 mol/L.
On se propose de vérifier cette concentration. On dose un volume V1 = 10,0 mL de cette solution par une solution de thiosulfate de sodium (
2Na+aq + S2O32-aq ) de concentration molaire C2 = 5,0 10-2 mol/L.
Le dispositif de dosage est représenté ci-dessous :
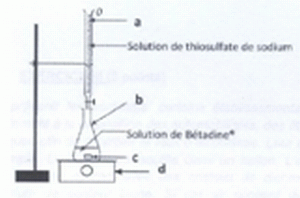
Nommer les éléments a, b, c et d.
a : burette graduée ; b : erlenmeyer ; c : turbulent, petit aimant ; d : agitateur magnétique.
La réaction support du dosage est : I2
+ 2S2O32-= 2I- + S4O62-
.
Les deux couples oxydant / réducteur sont : I2 / I- ; S4O62- / S2O32-.
Quel est le réactif oxydant ? Quel est le réactif réducteur ?
Lors du dosage S2O32- est
oxydé ; I2 est réduit.
2S2O32- =S4O62-
+ 2e- (1) oxydation du
réducteur S2O32-.
I2 +2e- = 2I- (2)
réduction de l'oxydant
I2.
La solution de diiode est de couleur orange. Les autres espèces sont incolores en solution aqueuse.
Parmi les deux propositions suivantes, choisir celle qui permet de repérer l'équivalence, expliquer votre choix.
(1) A l'équivalence, la solution initialement orange se décolore.
(2) A l'équivalence, la solution initialement incolore devient orange.
L'erlenmeyer contient le diiode de couleur orange. Avant l'équivalence
le diiode est en excès ( couleur orange ) ; après l'équivalence, le
diiode est en défaut ( solution incolore ) : donc (1) est vraie.
Définir l'équivalence d'un dosage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès ; après l'équivalence, l'autre réactif est en excès.
L'équivalence est obtenue lorsqu'on a versé un volume V2E = 6,5 mL de solution de thiosulfate de sodium. La concentration molaire en diiode est donnée par la relation suivante : C1 = ½C2V2E / V1.
Calculer C1. Conclure.
C1 =0,5 *5,0 10-2 *6,5 / 10 = 1,625 10-2 ~1,6 10-2 mol/L.
" La concentration molaire en diiode ( I2) de cette solution est de l'ordre de 1,7 10-2 mol/L".
Ecart relatif : (1,7 10-2- 1,625 10-2) /1,625 10-2 = 4,4 10-2 ( 4,4 %).
A 4,4 % près le résultat du calcul est en accord avec l'indication fournie.
|
|