|
Une
astuce culinaire : conductimétrie, acide base, constante d'équilibre :
bac S Nlle Calédonie 2010 |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
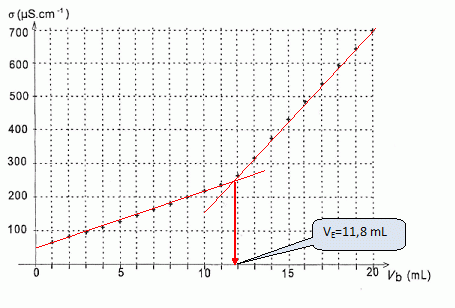
Dans cet exercice, on s'intéresse tout d'abord au dosage d'un vinaigre à usage culinaire, puis au comportement de la triméthylamine dans l'eau et enfin à l'intérêt d'ajouter du vinaigre dans l'eau de cuisson d'un poisson. On admet que l'odeur nauséabonde du poisson ne provient que de la triméthylamine. On donne : pKa1( CH3COOH aq / CH3 COO-aq) = 4,8 ; pKa2( ( CH3)3NH+ aq / ( CH3)3N aq) = 9,8 ; ( CH3)3NH+ aq / ( CH3)3N aq) pourra être noté BH+aq / B aq. Dosage du vinaigre utilisé en cuisine. Le vinaigre est une solution aqueuse diluée contenant essentiellement de l'acide éthanoïque de formule CH3 COOH. La solution de vinaigre commerciale, notée S0, étant trop concentrée, on la dilue 20 fois pour obtenir une solution de vinaigre diluée notée S1. On prélève précisément un volume V1 = 10,0 mL de solution diluée S1 de concentration C1. On réalise un dosage conductimétrique de la solution S1 par une solution titrante d'hydroxyde de sodium( Na+ + HO-) de concentration cb= 5,0 10-2 mol/L. La figure suivant représente la variation de la conductivité de la solution en fonction du volume vb sde solution titrante versé. Déterminer graphiquement le volume vE de solution d'hydroxyde de sodium versé à l'équivalence.
Ecrire l'équation de
la réaction support du dosage.
Comportement de la triméthylamine dans l'eau. On dispose d'un volume V = 50 mL d'une solution aqueuse de triméthylamine de concentration molaire en soluté apportée C = 1,0 10-2 mol/L. On mesure le ph de cette solution. Le pH-mètre indique pH = 10,9. L'équation de la réaction entre la triméthylamine et l'eau est : CH3)3N aq+ H2O(l) = CH3)3NH+ aq + HO-aq. Déterminer à l'équilibre la concentration [H3O+]éq dans la solution. [H3O+]éq = 10-pH = 10-10,9 = 1,26 10-11 mol/L. En déduire, à l'équilibre, la concnetration [HO-]éq et la quantité de matière n(HO-)éq en ion hydroxyde dans la solution. [HO-]éq = 10-14 / [H3O+]éq =1,0 10-14 /10-10,9 = 10-3,1 =7,94 10-4 ~7,9 10-4 mol/L. n(HO-)éq = [HO-]éq V = 7,94 10-4 *0,050 =3,97 10-5 ~4,0 10-5 mol. Calculer la quantité de matière n0 apportée en triméthylamine. n0 = C V = 1,0 10-2 *0,050 =5,0 10-4 mol. Compléter le tableau descriptif d'évolution du système.
t =xf / xmax= 5,0 10-5 / 5,0 10-4= 0,10, valeur inférieure à 1, la transformation n'est pas totale. Montrer que le rapport [(CH3)3NH+]éq / [(CH3)3N]éq = xf / (n0-xf ). [(CH3)3NH+]éq = xf / V ; [(CH3)3NH+]éq + [(CH3)3N]éq = n0 / V soit : [(CH3)3N]éq = n0 / V- xf / V. Par suite : [(CH3)3NH+]éq / [(CH3)3N]éq = xf / (n0-xf )
|
|||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||