|
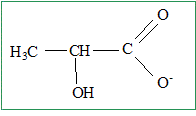
L'acide
lactique. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Il y a deux mois, un athlète a mesuré la concentration en acide lactique de son sang après un 800 m. Elle était de 1,90 g/L. Aujourd'hui il veut se refaire tester dans les mêmes conditions. On lui prélève V = 1,00 mL de sang et on en extrait la totalité de l'acide lactique. Cet acide est introduit dans une fiole jaugée de 50,0 mL contenant un peu d'eau distillée. On agite jusqu'à dissolution complète. On complète la fiole jaugée avec de l'eau distillée jusqu'au trait de jauge. On appelle S la solution obtenue. On réalise le dosage du volume V1 = 50,0 mL de la solution S par une solution aqueuse de soude de concentration molaire c1 = 1,00 10-3 mol/L. L'équivalence est atteinte pour un volume de solution de soude VE= 20,0 mL. On donne la constante d'équilibre de la réaction entre les ions hydroxydes et l'acide lactique : K= 1,3 1010 à 25°C. Ecrire la formule semi-développée de la base conjuguée de l'acide lactique.
Ecrire l'équation de la
réaction de dosage.
Etablir
l'expression de la constante d'acidité du
couple acide lactique / ion lactate en fonction de
la constante d'équilibre K puis calculer sa
valeur à
25°C.
K est très grand : la transformation est totale. Etablir l'expression de la concentration molaire en acide lactique de la solution S en fonction des données. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques ; V1CA = C1VE ; CA = C1VE / V1 = 1,00 10-3 * 20 / 50 = 4,00 10-4 mol/L Etablir l'expression de la concentration massique en acide lactique dans le sang puis la calculer. C1VE mol d'acide lactique dans V = 1,00 mL de sang soit C1VE / V mole d'acide lactique par litre de sang. Masse molaire de l'acide lactique : MA = 90,0 g/mol Concentration massique ( g/L) = MA C1VE / V = 90*1,00 10-3 * 20 = 1,8 g/L. L'entraînement subit par l'athlète depuis deux mois lui a t-il permis d'augmenter son potentiel ? Justifier. Cette valeur est inférieure à la concentration mesurée deux mois auparavent : l'athlète a donc augmenté son potentiel. A performance égale, la concentration en acide lactique dans le sang a diminué : l'athlète pourra courir plus vite sans produire plus d'acide lactique.Un lait frais ne contient pas d’acide lactique. En vieillissant, le lactose présent dans le lait se transforme en acide lactique, noté par la suite HA. Aspect expérimental : Erlenmeyer : Avec quel instrument ajoute t-on la solution de soude ? Donner son nom et le schématiser. Burette graduée :
On dose l’acide lactique, considéré comme le seul acide présent dans le lait étudié, par une solution d’hydroxyde de sodium : Na+ (aq) + HO- (aq) (soude) de concentration Cb = 5,00 x 10-2 mol.L-1. On prélève un volume VA = 20,0 mL de lait que l’on place dans un bécher et on suit l’évolution du pH en fonction de volume Vb de soude versé. Quelle(s) électrode(s) est ou sont nécessaire(s) à la mesure du pH d’une solution aqueuse ? Electrode combinée ou bien électrode de verre ( pour la mesure du pH) et une électrode au calomel saturée ( référence). Faire un schéma du dispositif expérimental. 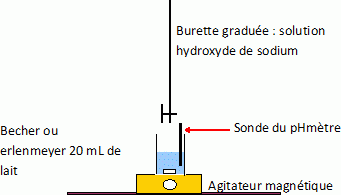 Ecrire l’équation de la réaction qui se produit lors du mélange. Quelle caractéristique doit présenter cette réaction pour être adaptée à un dosage ? AH aq + HO-aq = H2O(l) + A-aq. La réaction support d'un dosage doit être rapide et totale. Exprimer puis calculer la constante de réaction K correspondante. Conclure. Données : couple acide/base : H2O/HO-(aq) : pKa1 = 14, 0 ; H3O+(aq)/H2O : pKa2 = 0 ; HA(aq)/A-(aq) : pKa3 = 3, 9. 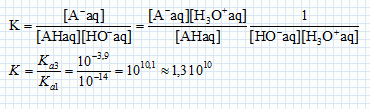 K est très grand, la réaction dans le sens direct est totale. On obtient les valeurs données dans le tableau suivant :
En utilisant un diagramme de prédominance, déterminer quelle est, entre HA et A- l’espèce chimique prédominante au début du dosage. 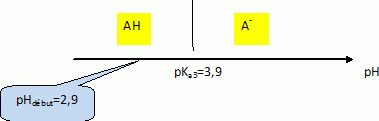 D’après le tableau de valeur pour quel volume de soude versé, HA et A- sont-elles présentes en quantité égales ? Justifiez votre réponse. à pH = pKa3 = 3,9, les concentrations de l'acide AH et de sa base conjuguée A- sont égales. On se trouve alors à la demi-équivalence du dosage. Le tracé du graphe représentant l’évolution du pH en fonction du volume de soude versé montre que l’équivalence acide base est atteinte pour un volume de soude VB = 12,0 mL.
|
|||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||
|
|