|
Dosage
du diiode, cinétique chimique. |
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
|
Une solution de Lugol est un antiseptique composé de diiode I2 que l'on dissout dans une solution de'iodure de potassium (K+ + I-). On se propose de téterminer la concentration molaire et le titre massique en diiode dans la solution commerciale étudiée. On effectue un dosage de cette solution par une solution aqueuse de thiosulfate de sodium (2Na+ + S2O32-) I- Préparation de la solution de thiosulfate de sodium : On désire préparer un volume V= 50,0 mL de la solution aqueuse de thiosulfate de sodium à la concentration C= 0,100 mol/L à partir du thiosulfate de sodium solide pentahydraté de formule Na2 S2O3, 5H2O.
On place la solution aqueuse de thiosulfate de sodium préparée dans une burette graduée de 25 mL. On introduit dans un bécher un volume V0= 10,0 mL de la solution de Lugol. On ajoute 20 mL d'eau distillée puis quelques gouttes d'empois d'amidon.
III- Exploitation :
Masse de solide à peser et le
matériel à utiliser : masse molaire Na2 S2O3,
5H2O : M= 2*23+2*32,1+3*16+5*18 =248,2 g/mol Quantité de matière (mol) = volume (L) * concentration
(mol/L) = VC= 0,05*0,1 = 5 10-3 mol masse (g) = quantité de matière (mol) * masse molaire
(g/mol) = 5 10-3 * 248,2 =1,24 g. capsule, entonnoir, spatule, balance ; pissette d'eau
distillée, fiole jaugée de 50 mL. Verrerie à utiliser pour mesurer le volume de la
solution de Lugol et les 20 mL d'eau distillée : Pour mesurer un volume précis V0= 10,0 mL ( 3
chiffres significatifs) on utilise pipette jaugée de 10,0 mL. Pour mesurer un volume peu précis, 20 mL d'eau
distillée, on utilise une éprouvette graduée de 50 mL. Lors du dosage S2O32- est oxydé ; I2 est réduit. 2S2O32- =S4O62- + 2e- (1) oxydation du réducteur le plus fort. I2 +2e- = 2I- (2) réduction de l'oxydant le plus fort En ajoutant (1) et (2) on écrit l'équation du dosage : I2 + 2S2O32-= 2I- + S4O62- . L'équivalence est observée pour un volume versé VE= 8,0 mL de la solution de thiosulfate de sodium. Avant l'équivalence, dans le becher, le diiode est en excès ; après l'équivalence l'ion thiosulfate est en excès. rôle de l'empois d'amidon : indicateur de fin de réaction en présence de diiode , l'empois d'amidon forme un complexe de couleur violet foncé ( couleur de la solution avant l'équivalence) ; après l'équivalence, toutes les espèces sont incolores. Un changement de teinte est observé à l'équivalence. Exploitation :Relation entre la quantité de matière n(I2) de diiode apporté par la prise d'essai et la quantité de matière n(S2O32-) d'ions thiosulfate versés à l'équivalence : I2 + 2S2O32-= 2I- + S4O62- D'après les coefficients stoechiométriques de l'équation ci-dessus : n(S2O32-) = 2 n(I2) Or n(S2O32-) = CVE et n(I2) = C0V0 ; CVE = 2 C0V0 La concentration C0 en diiode de la solution commerciale de Lugol peut donc s'écrire : C0 = CVE / (2V0). Calcul de C0 : 0,1 * 8 / (2*10 ) = 4,00 10-2 mol/L. Masse de diiode par litre de solution : C0*M(I2
) = 0,04*2*126,7 = 10,1 g/L.
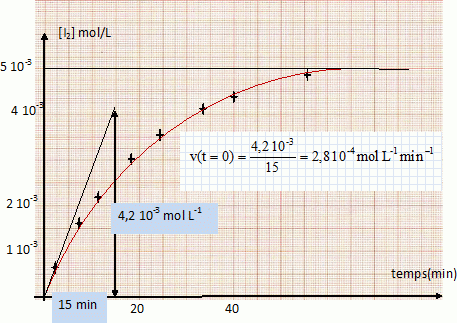
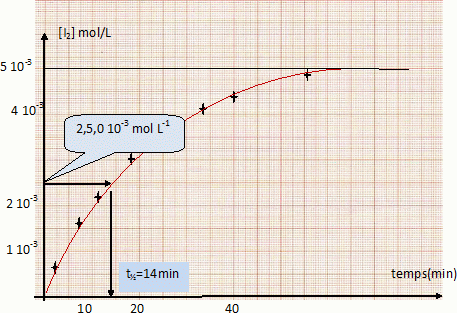
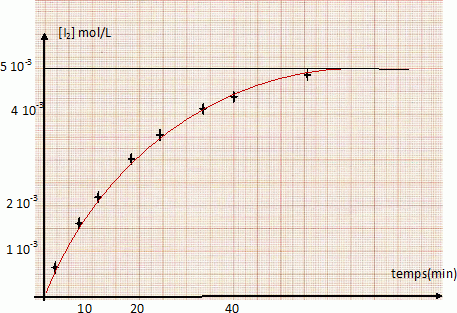
On mélange dans un bécher 100 cm3 d’une solution de concentration molaire 2.10-2 mol.L-1 d’iodure de potassium KI et 100 cm3 d’une solution de concentration molaire 10-2 mol.L-1 de peroxidisulfate de potassium K2S2O8 (réaction 1). La solution devient jaunâtre par suite de l’apparition progressive d’iode. On se propose d’étudier la vitesse de formation du diiode en fonction du temps. Pour cela, on opère des prélèvements de 10 cm3 du milieu réactionnel aux différents temps t. La réaction de formation du diiode dans les prélèvements est arrêtée par dilution dans de l’eau distillée glacée. On dose alors l’iode présent dans les prélèvements au moyen d’une solution titrée de thiosulfate de sodium Na2S2O3 de concentration molaire 0,01 mol.L-1, cette réaction de dosage étant supposée instantanée (réaction 2). Données : E° ( S2O82- / SO42- ) =2,01 V ; E° ( S4O62- / S2O32- ) =0,08 V ; E° ( I2 / I- ) =0,62 V. Ecrire les équations-bilan des réactions 1 et 2. S2O82- +2e-= 2SO42- ; 2I- = I2 +2e- . S2O82- +2I- = 2SO42- + I2 (1). 2S2O32- =S4O62- +2e- ; I2 +2e- = 2I- ; 2S2O32- + I2 = S4O62- + 2I- (2). On mesure le volume V de solution de thiosulfate de sodium versé dans chacun des prélèvements du milieu réactionnel. Etablir la relation liant la concentration molaire du diiode formé en fonction du volume V (en cm3). n(I2) =½ n(S2O32-) = 0,5 C V = 0,5*0,01 V= 5 10-3 V ( mmol) Compléter la 3è ligne du tableau suivant. [I2] = 5 10-3 V / volume prélevement = 5 10-3 V / 10 = 5 10-4 V mol/L
|
||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||
|
|