Le
luminol ou 5-amino-2,3-dihydrophtalazine-1,4-dione est un composé organique de formule
brute C8H7N3O2. Sa réaction avec
certains oxydants conduit à l’émission d'une lumière d'un éclat bleu
caractéristique. On parle de chimiluminescence. L'oxydant
habituellement utilisé est l'eau oxygénée H2O2(aq). On
obtient alors après réaction des
ions aminophtalate, du diazote et de l'eau.
Les ions
aminophtalate sont dans ce cas dans un état excité. Ils vont retrouver leur
état de repos
en «dégageant leur surplus d'énergie» sous forme de photons, ce qui se traduit
par l'émission
d'une lumière bleue.
Toutefois,
cette réaction est très lente, elle
se compte en mois... Par contre, elle se
produit rapidement en présence d'un composé ferrique, c'est-à-dire un composé
contenant des ions fer III.
L'hémoglobine
des globules rouges du sang contient des ions fer III. Le luminol va servir à
déceler des traces de sang, même infimes, diluées par lavage ou séchées.
Après
avoir assombri les lieux, les techniciens de la police scientifique pulvérisent
un mélange de luminol et d'eau oxygénée. Au contact des endroits où du sang est
tombé, des chimiluminescences apparaissent avant de s'éteindre environ 30
secondes après. Un appareil photo mis en pose lente permet de localiser ces
traces.
D'après
le site : http://la-science-rattrape-jack.
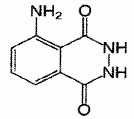 Molécule de luminol.
Molécule de luminol.
Données :
- Vitesse de la
lumière dans le vide : c = 3,0.108 m.s-1 ; Constante de Planck :
h = 6,63.10 –34 J.s ; La loi des gaz
parfaits s'écrit : P.V = n.R.T ;
Constante des gaz
parfaits : R = 8,3 SI.
La lumière
émise est une lumière bleue.
À quel domaine, mécanique ou électromagnétique, une onde lumineuse
appartient-elle ?
Une onde lumineuse est une onde électromagnétique.
Concernant le milieu de propagation, en quoi ces deux types d'onde se
différencient-ils ?
Une onde électromagnétique peut se propager dans le vide. Une onde
lmécanique ne se propage pas dans le vide. Une onde lmécanique ne peut
se propager que dans un milieu matériel.
La longueur d'onde
de l'onde émise est voisine de 400 nm.
Quelle énergie un photon émis transporte-t-il lors de la désexcitation des ions
aminophtalate ?
E = h c / l =6,63.10 –34 *3,0.108 / 400 10-9= 4,97 10-19 ~5,0 10-19 J.
Cette valeur serait-elle plus élevée si la lumière émise était rouge ?
Justifier.
La célérité dans le vide est identique pour le rouge et le bleu.
La longueur d'onde d'une lumière rouge étant supérieure à celle d'une
lumière bleue, l'énergie d'un photon émis dans le rouge sera
inférieure à l'énergie d'un photon émis dans le bleu.
|
La réaction
produite est une réaction d'oxydoréduction.
L'équation
de la réaction s'écrit :
2
C8H7N3O2 (aq) + 7 H2O2 (aq) + 4 OH – (aq) = 2 N2
(g)+ 2 C8H2O42– (aq) + 14 H2O
(l)
|
Pour
illustrer cette réaction, trois solutions sont préparées :
-
une solution S1 avec 1 g de luminol, 250 g d'hydroxyde de sodium
NaOH (s) et de l'eau distillée.
-
une solution S2 avec 5 g de ferricyanure de potassium K3Fe(CN)6
(s) et 250 mL d'eau distillée.
-
une solution S3 constituée de 0,5 mL d'eau oxygénée à 110 volumes.
Les
solutions S1 et S2 sont mélangées dans un bécher puis la
solution S3 est ajoutée. Le mélange réactionnel a un volume V = 350
mL.
On
constate qu'avant l’ajout de la solution S3, le mélange est jaune et
qu'après, des taches bleues apparaissent.
L'eau oxygénée joue
le rôle de l'oxydant. Qu'appelle-t-on oxydant ?
Un oxydant est une espèce, ion ou molécule, susceptible de gagner un ou plusieurs électrons.
Le titre d'une eau oxygénée exprime le volume de
dioxygène (mesuré en litres dans les conditions normales de température et de
pression) que peut libérer un litre d'eau oxygénée lors de la réaction de dismutation
:
2 H2O2 (aq) = O2 (g) + 2 H2O
(l).
Ainsi, une eau oxygénée à 110 volumes a une concentration
molaire C = 9,8 mol.L-1.
On veut vérifier la concentration molaire de la
solution d'eau oxygénée à 110 volumes. Cette solution est diluée 10 fois. On obtient la solution SR, de concentration molaire CR. Un prélèvement VR = 10,0 mL de cette
solution est dosé par une solution de permanganate de potassium acidifiée de
concentration molaire C0 =
0,50mol.L-1.
Les couples mis en jeu sont les suivants : MnO4–
(aq) / Mn2+ (aq) et O2 (aq) / H2O2
(aq).
Écrire l'équation de la réaction support du
dosage.
2 fois {
MnO4- + 8H+ +
5e- = Mn2+ + 4H2O
} réduction
5 fois
{H2O2 = O2 +
2H+ + 2e- }
oxydation
2 MnO4- + 5
H2O2 + 6H+ = 5
O2 + 2 Mn2+ + 8H2O.
Rappeler la définition de l'équivalence.
Comment l'équivalence est-elle repérée dans ce dosage ?
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès ; après l'équivalence, l'autre réactif est en excès.
L'ion permanganate est la seule espèce colorée ( violet). Il joue un
double rôle : celui de réactif et celui d'indicateur de fin de réaction.
Le volume de solution de permanganate de
potassium acidifié versé à l'équivalence est VE = 8,0 mL.
En déduire la concentration CR de la solution diluée SR et vérifier que la concentration de la solution d'eau
oxygénée à 110 volumes est voisine de celle annoncée. (On pourra s'aider d'un
tableau d'avancement).
état
|
avancement (mol)
|
2 MnO4- |
+ 5
H2O2 |
+ 6H+ = 5
O2 + 2 Mn2+ + 8H2O. |
initial
|
0
|
C0VE
|
CRVR
|
xxxxxxxxxxxxxxxxxxxxxxxx
|
en cours
|
x
|
C0VE-2x
|
CRVR-5x
|
équivalence
|
xéq
|
C0VE-2xéq =0
|
CRVR-5xéq=0 |
C0VE-2xéq =0 donne xéq =½ C0VE ; repport dans : CRVR-5xéq=0.
CRVR-2,5C0VE=0. CR= 2,5C0VE / VR= 2,5 *0,50 *8,0 / 10,0 = 1,0 mol/L. Tenir compte de la dilution au 1/10ème : C = 10 mol/L.
La réaction entre le luminol et l'eau oxygénée est une transformation
lente.
La réaction entre le luminol et l'eau oxygénée est
réalisée maintenant dans une enceinte fermée. On rappelle que le mélange
réactionnel a un volume V = 350 mL.
La formation de diazote crée une surpression qui
s'additionne à la pression de l'air initialement présent.
Grâce à un capteur de pression, on mesure, en fonction
du temps, la valeur de la pression P
à l’intérieur de l'enceinte.
Soit P0
la pression due à l'air régnant initialement dans l'enceinte, T = 300 K la température du milieu
(supposée constante durant l’expérience) et Vgaz
= 2,1 L, le volume de gaz contenu dans l'enceinte. Tous les gaz sont considérés
comme parfaits.
Exprimer P0
en fonction de n(air), Vgaz,
R et T si n(air) est la
quantité de matière d'air initialement présente dans l'enceinte.
n(air) = P0Vgaz / (RT).
Soit n(N2)
la quantité de matière de diazote formé au cours de la réaction
Exprimer P
en fonction de n(air), n(N2),Vgaz, R et T.
PVgaz =(n(air) +n(N2) ) RT ; P = (n(air) +n(N2) ) RT /Vgaz .
En déduire l'expression de la surpression P – P0.
P = n(air) RT /Vgaz +n(N2) RT / Vgaz = P0 + n(N2) RT / Vgaz .
P-P0 = n(N2) RT / Vgaz .
Soit n1et n2 les quantités
initiales de matière de luminol et d'eau oxygénée. Les ions hydroxydes HO–
(aq) sont introduits en excès.
Compléter le tableau d'avancement simplifié
donné . Déterminer la valeur de l'avancement maximum noté xmax.
Dans ce tableau, la quantité de diazote correspond exclusivement au diazote produit
par la réaction.
état
|
avancement (mol)
|
2
C8H7N3O2 (aq) |
+ 7 H2O2 (aq) |
+ 4 OH – (aq) |
= 2 N2
(g) |
+ 2 C8H2O42– (aq) |
+ 14 H2O
(l)
|
initial
|
0
|
n1 = 5,6 10-3
|
n2 = 4,9 10-3 |
excès
|
0
|
0
|
solvant
|
en cours
|
x
|
n1 -2x
|
n2 -7x |
2x
|
2x
|
final
|
xmax
|
n1 -2xmax |
n2 -7xmax |
2xmax |
2xmax |
Si C8H7N3O2 (aq) est en défaut : n1 -2xmax=0 ; xmax=2,8 10-3 mol.
Si H2O2 (aq)est en défaut : n2 -7xmax=0 ; xmax=7,0 10-4 mol. ( on retient la plus petite valeur ).
|
|
Établir la relation entre x l'avancement de la
réaction, la surpression (P – P0), Vgaz, R et T.
n(N2) = 2x ;
P-P0 = n(N2) RT / Vgaz = 2xRT / Vgaz.
On mesure, dans l’état final, une surpression de 1660
Pa. Retrouver la valeur xmax de l’avancement maximal.
xmax = ( P-P0)Vgaz / (2RT).
xmax =1660 *2,1 10-3 / (2*8,3*300) =7,0 10-4 mol.
Un logiciel permet de traiter les mesures de pression
P afin d'obtenir ta courbe x = f(t) donnée. La tangente (T) à
l’origine a été tracée.
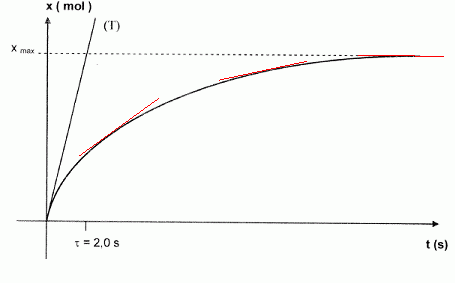
La vitesse volumique de réaction à la date t est
donnée par la relation |
 Molécule de luminol.
Molécule de luminol.