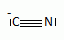|
Réduction par LiAlH4, substitution dérivé halogéné, organomagnésien, annelation Robinson concours Capes 2010. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||
| .
. |
||||||||||
|
||||||||||
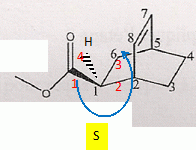
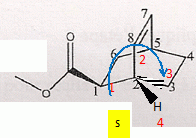
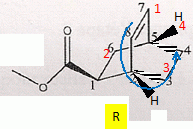
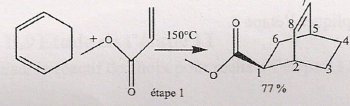 Nommer les deux réactifs qui interviennent dans l'étape 1. cyclohex-2,3-diène ; 2-propènoate de méthyle. Nommer la réaction chimique qui explique la transformation chimique observée. Synthèse diènique ( Diels Alder ). Déterminer la configuration absolue des carbones asymétriques de la molécule formée en expliquant succintement la démarche. numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S).
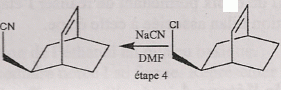
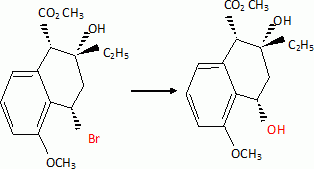
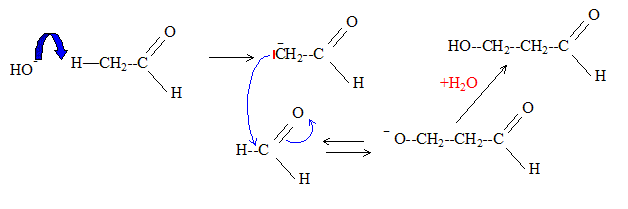
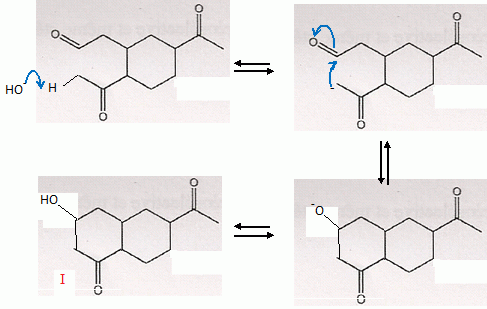
La structure pontée est rigide. Les carbones 2 et 5 ont toujours la même configuration et possèdent les mêmes substituants en a. Le carbone 1 présente deux configurations : donc deux isomères.
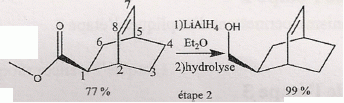
Etape 3.
étape 4 :
Liquide incolore, miscible à l'eau et à la majorité des liquides organiques.
C'est un solvant aprotique et polaire.
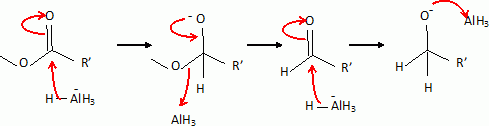
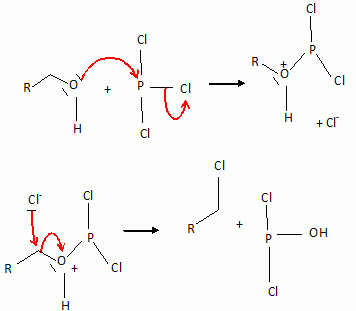
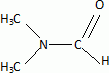
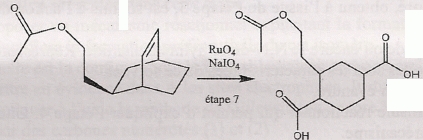
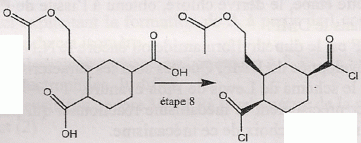
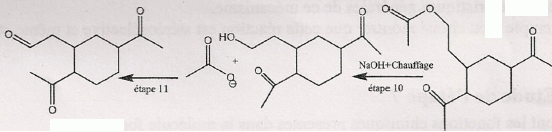
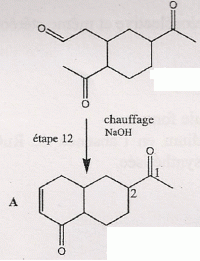
étape 7. Etape 8. On note R- le groupement : CH3COOCH2CH2-.On utilise un agent halogénant : chlorure de thionyle, trichlorure de phosphore. Dans la conformation chaise du cyclohexane, les substituants équatoriaux sont décalés : ils se projettent alternativement au dessus et en dessous du plan du cycle. En position axiale il existe des interactions ( gène stérique ) entre lui et les atomes axiaux.  Etape 9 : L'organocuprate joue un rôle comparable à un organomagnésien. 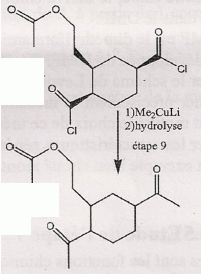 Ecrire un schéma réactionnel expliquant cette réaction. On remplace Me2Cu Li par CH3MgBr. 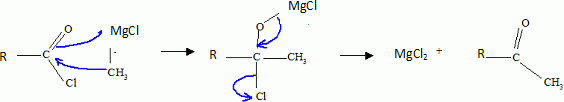 En présence de CH3MgBr introduit en large excès et après hydrolyse acide, quel(s) composé(s) aurait-on obtenu(s) ? L'organomagnésien peut ensuite par le même mécanisme réduire la cétone en alcool tertiaire ; par contre avec les cuprate on s'arrête au stade cétone. Nommer en nomenclature systématique CH3MgBr. Bromure de méthylmagnésium Citer les réactifs nécessaires, ainsi qu'un solvant adapté à la synthèse de CH3MgBr. Quelles sont les caractéristiques du solvant choisi ? Bromure de méthyle et magnésium ; le solvant peut être l'éther éthylique ou le THF anhydre. Un éther anhydre est une base de Lewis ; les doublets non liants de l'atome d'oxygène stabilise le centre actif du magnésien. Le solvant doit être anhydre : la réaction eau + RMgX est vive. 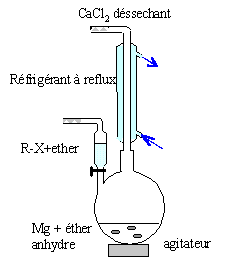 Le support élévateur permet de placer un bain-marie ( en début de réaction ). On le remplacer rapidement par un cristallisoir d'eau froide si la réaction devient trop rapide. On peut observer l'ébullition de l'éther. La synthèse d'un organomagnésien est exothermique.
|
||||||||||
| |
||||||||||
|
|