|
L'aspirine : synthèse, dosage bac S Amérique du Sud 2009. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
Données :
Masses molaires :
-
de l’acide salicylique : Mac = 138 g.mol -1
-
de l’anhydride acétique (ou éthanoïque) : Manh = 102
g.mol
-1
-
de l’aspirine : Masp = 180 g.mol -1 Masse volumique de l’anhydride acétique (ou éthanoïque) : r = 1,08 g.mL -1
Structure et formulation. Donner le nom des
groupes caractéristiques
encadrés dans les formules topologiques de : la
salicine ; l’acide salicylique ; l’acide
acétylsalicylique. 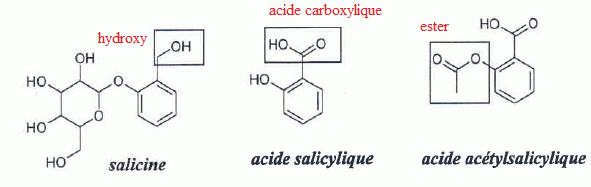 L’acide salicylique
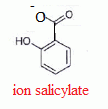
possède une base
conjuguée, l’ion salicylate, mentionné dans le texte. Donner
sa formule topologique.
De la même manière, l’acide
acétylsalicylique ou aspirine, possède une base conjuguée,
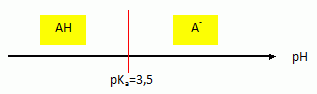
l’ion acétylsalicylate. Le couple, qu’on notera plus simplement AH/A-
possède un pKa de 3,5.
Tracer son diagramme
de prédominance. Sachant que le pH de
l’estomac est
voisin de 1, citer l’espèce prédominante de ce couple. Quand
l’aspirine reste trop longtemps sous cette forme
prédominante dans l’estomac, elle y provoque des lésions gastriques.
C’est
pourquoi on trouve dans le commerce des formulations en poudre, moins
agressives, à base d’acétylsalicylate de sodium, associé à de
l’hydrogénocarbonate de sodium. La dissolution de la poudre dans un
verre d’eau est
rapide et totale. La solution obtenue contient les ions
acétylsalicylate A–(aq)
et hydrogénocarbonate, de formule HCO3–(aq). Données : pKa
du couple (CO2,
H2O)(aq) / HCO3–(aq)
=
6,4
Après
absorption, ces ions pénètrent dans l’estomac où le
pH est très acide. Écrire l’équation de la réaction se produisant entre les ions hydrogénocarbonate et les ions oxonium présents en abondance dans l’estomac. HCO3–(aq) + H3O+aq =
CO2 aq + 2H2O(l). Calculer la constante d’équilibre K de cette réaction. K = [CO2 aq , H2O]
/ ([H3O+aq][HCO3–(aq)])
= 1 / Ka = 1/ 10-6,4 =2,5 106. Au moment
de
l’ingestion du verre d’aspirine, le quotient de réaction initial est
faible par
rapport à K, en
déduire l’influence des ions hydrogénocarbonate sur le pH de
l’estomac.
Synthèse.
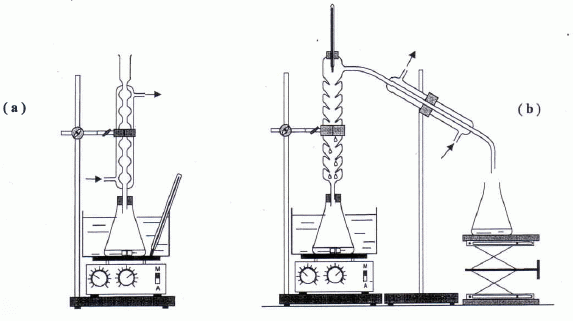
Lequel de ces deux montages permet de
réaliser un chauffage à reflux ?
Justifier.
Donner la formule
semi-développée de l’anhydride acétique (ou éthanoïque). Pourquoi utilise-t-on l’anhydride
éthanoïque
plutôt que l’acide acétique pour cette synthèse ? Écrire l’équation de
la synthèse de
l’aspirine à partir de l’anhydride acétique et de l’acide salicylique. 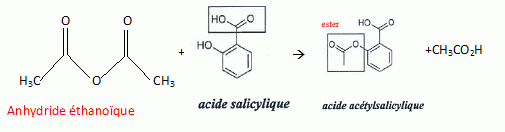 Dans
un erlenmeyer bien sec, on introduit 10,0 g d’acide
salicylique, 12,0 mL d’anhydride acétique et 0,50 mL
d’acide sulfurique concentré. À quoi sert l’acide
sulfurique ?
Si l'anhydride est en défaut : 0,127-xf
=0 ; xf
=0,127 mol
Après 20 minutes de chauffage,
on sort
l’erlenmeyer du bain-marie. On introduit par le haut du
réfrigérant 20 mL d’eau distillée pour détruire l’anhydride
acétique restant. Quand
l’ébullition a cessé, on ajoute 50 mL Calculer le rendement de cette synthèse. mexp / mthéo=10,5 / 13,04 =0,805 ~ 80,5 %.
|
|||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||
|
|