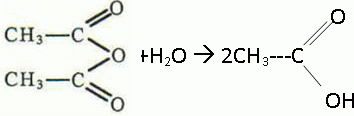|
L'aspirine
ne soigne pas que la douleur :
bac S Polynésie 09 /2010 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
|
|||||||
|
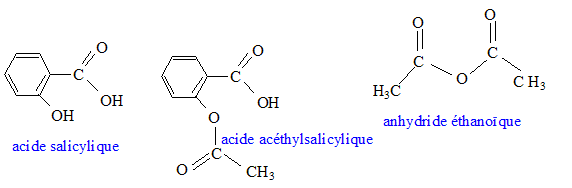
En 1829, le pharmacien français henry Leroux isole le principe actif de l'écorce de saule, la salicine. Il faudra encore près de trois quart de siècle pour passer de la salicine à l'acide acéthylsalicylique que la firme allemenande bayer commercialise finalement en 1899 sous le nom d'aspirine. Pendant plus de 100 ans, ce médicament a permis de soulager les douleurs et la fièvre. Récemment, de nouvelles indications thérapeuthiques sont apparues comme la prévention de certains cancers. Sa synthèse au laboratoire est relativement aisée. Données :
Masse volumique de l'anhydride éthanoïque r =1,08 g mL-1. pKa du couple acide acéthylsalicylique / ion acéthylsalicylate : 3,5 à la température de l'expérience. L'acide salicylique et l'aspirine sont des solides peu solubles dans l'eau, solubles dans l'éthanol. l'anhydride éthanoïque est un liquide qui réagit vivement avec l'eau. Pictogrammes relevés sur le flacon d'anhydride éthanoïque : 
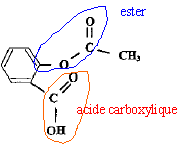
l'anhydride éthanoïque réagit vivement et totalement avec l'eau en donnant de l'acide éthanoïque. On peut obtenir l'aspirine à partir d'anhydride éthanoïque et
d'acide salicylique ou d'acide éthanoïque et d'acide salicylique. 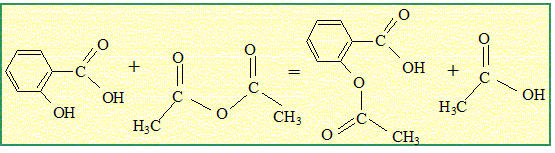 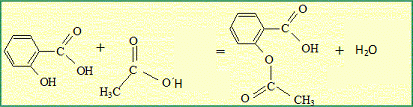 Quelle est la transformation qui permet d'atteindre l'avancement maximal ? Pourquoi ? La réaction entre l'acide salicylique et l'anhydride est totale. En absence d'eau, la réaction inverse, l'hydrolyse de l'ester ne se produit pas. L'avancement maximal est atteint. Quelles précautions doit-on prendre pour l'utilisation de l'un au moins des réactifs ? Pictogrammes relevés sur le flacon d'anhydride éthanoïque :  L'anhydride éthanoïque est corrosive : mettre des gants, des lunettes de protection et une blouse ; travailler sous hotte aspirante.
Choisir parmi les montages proposés celui qui convient pour cette synthèse. Indiquer le sens de circulation de l'eau de refroidissement dans le réfrigérant. 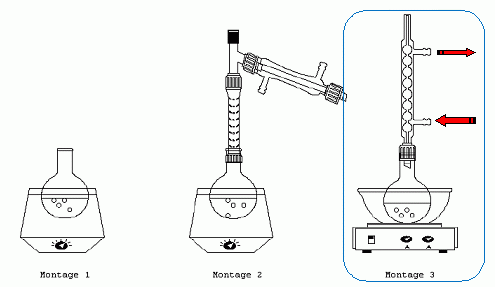 Pourquoi a-t-on choisi un ballon initialement bien sec ? L'anhydride éthanoïque réagit vivement avec l'eau en donnant de l'acide éthanoïque. Définir et calculer le rendement de la synthèse. Quantités de matière initiales : acide salicylique n = m/M = 13,8 /138 = 0,10 mol ; anhydride éthanoïque : masse : 25*1,08 =27 g ; n' = 27/102 =0,265 mol L' Rendement : quantité de matière réelle / quantité de matière théorique *100 rendement : 0,050 / 0,10 *100 = 50 %.
|
|||||||
| |
|||||||
|
|