|
Titrage
des ions dans une eau minérale : bac S
centre étrangers 2010 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Les eaux minérales contiennent des espèces dissoutes. La législation impose un étiquetage précisant les quantités contenues dans un litre d'eau. Sur l'étiquette endommagée d'une bouteille d'eau minérale gazeuse, on peut lire les valeurs des concentrations massiques en ions données dans le tableau ci-dessous. Les valeurs concernant les ions chlorure et les ions calcium ne sont plus lisibles.
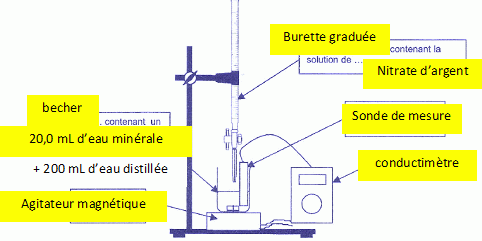
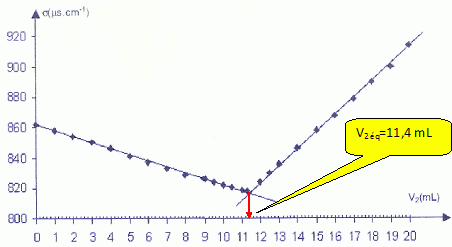
On dégaze l'eau minérale par agitation et on prélève un volume V1 = 20,0 mL que l'on introduit dans un grand becher. On rajoute un volume d'environ 200 mL d'eau distillée. On plonge dans le milieu une cellule de conductimétrie. A l'aide d'une burette graduée on ajoute progressivement une solution aqueuse de nitrate d'argent ( Ag+aq + NO3-aq ) de concentration molaire c2 = 2,00 10-2 mol/L. Le mélange obtenu dans le becher est maintenu sous agitation régulière. On donne la courbe d'évolution de la conductivité s du mélange en fonction du volume V2 versé dans la solution de nitrate d'argent. Compléter le schéma du dispositif utilisé lors du titrage.
Lors de ce titrage les ions chlorure Cl-aq réagissent avec les ions argent Ag+ aq pour former un précipité blanc de chlorure d'argent AgCl(s).
En déduire la relation entre n1 et n2 éq.
Titrage complexométrique des ions calcium. On utilise comme solution titrante, une solution d'acide Ethylène Diammine Tétracétique ( EDTA ). Ce titrag se fait en présence d'indicateur coloré de fin de réaction et d'une solution tampon permettant de maintenir le pH de la solution entre 9 et 10. On réalise le titrage d'un volume V'1 = 20,0 mL d'eau minérale par la solution d'EDTA de concentration c'2 = 5,0 10-3 mol/L. A l'équivalence, le volume versé d'EDTA est V'2 éq = 10,8 mL. En milieu basique, l'EDTA contient des ions notés Y4- qui réagissent avec les ions calcium ( Ca2+) et magnésium ( Mg2+) contenus dans l'eau minérale pour former des complexes très stables selon les équations : Ca2+aq + Y4- aq = [Ca Y]2-aq. Mg2+aq + Y4- aq = [Mg Y]2-aq. Soient ni(Ca2+) et ni(Mg2+) les quantités de matière initiales d'ions calcium et magnésium présents dans le volume V1 d'eau minérale. n'2éq désigne la quantité de matière d'ion Y4- versé pour atteindre l'équivalence. Quelle relation lie ces trois quantités de matière ? n'2éq = ni(Ca2+) + ni(Mg2+).
|
|||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|