Partie 1 – Étude de l’extraction de la caféine
La première méthode industrielle d’obtention de la caféine a été son extraction à partir de café vert.
Une extraction est effectuée au laboratoire avec du café vert robusta
composé de glucides (60 % de masse sèche), de lipides (11 à 17 % de
masse sèche), de protéines (14 % de masse sèche), d’acide chlorogénique
(6 à 11 % de masse sèche)
et de caféine (2,0 % de masse sèche).
L’extraction est réalisée en deux étapes :
- première étape : la caféine est extraite des grains de café par de l’eau ;
- deuxième étape : l’extraction de la caféine de la solution aqueuse précédemment obtenue est réalisée par un solvant organique.
Le laboratoire dispose d’acétate d’éthyle, de dichlorométhane,
d’éthanol et d’acétone. L’acétate d’éthyle est choisi comme solvant
organique pour la deuxième étape.
Étude de la première étape : extraction solide-liquide
On extrait la caféine contenue dans une masse m
0 = 1,5 kg de café vert contenant 14 % d’eau en plus de la composition de masse sèche donnée plus haut.
1. À partir des
données physicochimiques de la caféine, proposer une technique et
justifier le solvant à utiliser pour mettre en oeuvre l’extraction de
la caféine au laboratoire.
Extraction par solvant : la caféine est un peu soluble dans l'eau.
2. Justifier que l’acide chlorogénique est aussi extrait des grains de café au cours de cette opération.
L’acide chlorogénique est également un peu soluble dans l'eau.
À l’issue de l’extraction, on obtient une masse m
s = 5,95 kg d’une solution aqueuse de caféine, notée S, et une masse m
1,h = 2,45 kg de grains de café humides.
On cherche maintenant à déterminer la masse de caféine effectivement extraite par cette méthode.
Dosage de la caféine dans la solution S par iodométrie.
À une prise d’essai de solution S de caféine, on ajoute un volume V
0
de solution acidifiée de diiode en présence d’un excès iodure de
potassium (KI). La concentration de la solution de diiode ajoutée vaut
C(I2) = 0,0500 mol·L
–1.
Le diiode est introduit en excès. La caféine réagit totalement avec le
diiode pour former un précipité selon la réaction d’équation :
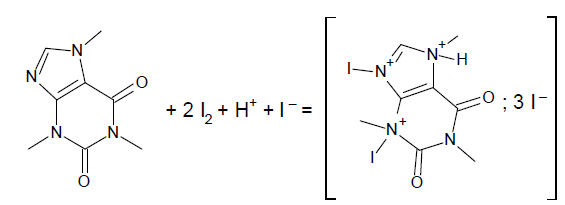
Après filtration et élimination du précipité, le diiode en excès
contenu dans un échantillon de solution S de volume E = 10,00 mL est
dosé en présence d’acide sulfurique par une solution de thiosulfate de
sodium de concentration
C
T = 0,050 mol·L
–1 suivant la réaction d’équation :
I
2(aq) + 2 S
2O
32–(aq) = 2 I
–(aq) + S
4O
62–(aq)
Le volume de solution d’ions thiosulfate versé à l’équivalence vaut V
X = 10,360 mL.
On dose le même volume V
0 de solution de diiode en présence
d’acide sulfurique par la solution de thiosulfate de sodium. Le volume
de solution d’ions thiosulfate versé à l’équivalence lors de ce dosage
vaut V
T = 20,600 mL.
3. Expliquer pourquoi il est nécessaire de filtrer le précipité avant d’effectuer le dosage par la solution d’ions thiosulfate.
L'ajout d'iode et de H
2SO
4 entraîne la formation d'un précipité rouge brique dû à la réaction de la caféine et de l'iode.
4. Exprimer la quantité de matière en diiode présent dans le volume V
0 en fonction de V
T et C
T.
n(
S2O32–) =2n(
I2) ;
n(S2O32–) =VT CT ; n(I2)=VT CT / 2.
5. Établir que la
relation permettant de calculer la concentration en quantité de matière
de la caféine dans la solution dosée, notée C
caf, s’exprime :
C
caf =C
T(V
T − V
X)/ (4 E)
n(caf) = n(I
2) / 2.
Quantité de matière de diiode ayant réagi avec la caféine : CT(VT − VX) / 2.
n(caf) =CT(VT − VX) / 4.
Ccaf =CT(VT − VX)/ (4 E)
6. Déterminer la concentration en masse de la solution S, notée C
masscaf expriméeen g·L
–1.
C
caf=0,05(20,6-10,36) /(4 x10)=0,0128 mol / L.
M(caféine) =194,19 g / mol.
Cmasscaf =0,0128 x194,19 =2,485 g / L.
7. Sachant que la densité de la solution S vaut 1,005 à 20 °C, calculer le rendement d’extraction solide / liquide.
Masse de caféine dans la solution S : 1,005 x10 =10,05 g.
Rendement : 2,485 / 10,05 =0,237 ( 23,7 %).
Étude de la deuxième étape : extraction liquide-liquide
8. Donner deux arguments justifiant le choix de l’acétate d’éthyle comme solvant d’extraction.
La caféine est très soluble dans l'acétate d'éthyle. L'acétate d'éthyle est très peu miscible avec l'eau.
9. Établir les
diagrammes de prédominance de la caféine et de l’acide chlorogénique
puis proposer l’intervalle de pH adapté pour extraire uniquement la
caféine lors de la seconde extraction.
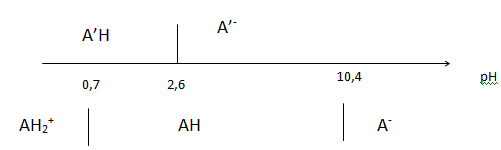
La caféine doit être majoritairement sous forme moléculaire et l'acidechlorogénique principalement sous forme ionique.
Donc pH voisin de 5 ou 6..
Étude de l’extraction liquide-liquide à l’échelle du pilote.
On
alimente une colonne d’extraction liquide-liquide avec une masse m’s =
988 g de solution S. La caféine est extraite dans de l’acétate
d’éthyle. Les résultats de l’extraction sont compilés dans le tableau
ci-dessous :
|
|
r ( kg dm-3)
|
m(kg)
|
C (g/L)
|
Entrée
|
Alimentation
|
1,005
|
0,988
|
2,49
|
solvant
|
0,902
|
0,880
|
0
|
Sortie
|
extrait
|
0,906
|
0,711
|
2,21
|
raffinat
|
0,994
|
0,970
|
|
10. Calculer les pertes globales de ce procédé.
On considère que l’extraction liquide-liquide n’est à l’origine d’aucune perte de masse de caféine.
0,988 +0,880 -0,711 -0,970 =0,187 kg.
11. Calculer la concentration en masse en caféine attendue dans le raffinat, donnée manquante du tableau précédent.
Raffinat : phase initialement riche en soluté.
Extrait : phase enrichie en soluté.
Volume = 0,970 / 0,994 =0,976 dm
3.
C = masse / volume = 0,970 / 0,976 =0,994 g / L.
12. Calculer le rendement de l’extraction liquide-liquide puis celui de l’ensemble des deux extractions.
Rendement : masse de soluté extrait / masse de soluté à extraire.
0,711 / 0,988=0,72 ( 72 %).
0,72 x 0,237 =0,17 (17 %).
13. Nommer et
décrire sommairement les deux techniques à mettre en oeuvre au
laboratoire pour obtenir de la caféine pure à l’issue de cette
extraction.
Evaporateur rotatif ; distillation
L’obtention de caféine par extraction donnant lieu à un faible rendement, le laboratoire envisage une voie de synthèse.