Mathématiques, physique chimie. Bac STL 09 /
2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| .
. |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice 1 (5,5 points) : radioactivité et cinétique chimique
Les parties A et B sont indépendantes et présentent chacune une
situation concrète dont la modélisation relève d’une équation
différentielle du premier ordre.
Partie A : DANS LE DOMAINE DE LA RADIOACTIVITÉ
La tomographie par émission de positons (TEP ou PETscan) repose sur
l’injection intraveineuse d’une substance (le « traceur ») marquée par
un atome radioactif, le fluor 18 ou le carbone 11, qui émet des
particules particulières, les positons. Le traceur est choisi pour se
fixer sur un organe ou un tissu.
D’après https://www.vidal.fr/sante/examens-tests-analyses-medicales/tomographie-emission-positons-petscan.html
1. Le fluor 18 ( 189F) est un isotope radioactif du fluor. Donner la composition du noyau de l’isotope 18 du fluor.
9 protons et 18-9 = 9 neutrons.
Le fluor 18 se désintègre spontanément pour donner l’isotope 18 de l’oxygène ( 188O). L’équation de cette réaction nucléaire s’écrit :
189F--> 188O +YZX
2. Déterminer Y et Z. Préciser le type de cette désintégration ( a, ß - ou ß +).
Conservation de la charge : 9=8+Z ; Z = 1.
Conservation du nombre de nucléons : 18 = 18+Y ; Y = 0.
YZX est 01e, positon, radioactivité de type ß+.
Lors de l’utilisation du traceur radioactif, et afin de déterminer les
doses à injecter, on définit « l’activité du traceur », notée A, comme
le nombre de désintégrations par seconde, pour un échantillon donné.
Elle est exprimée en becquerel (Bq).
Pour mener l’examen, il faut injecter une dose de traceur dont
l’activité est proportionnelle à la masse du patient. L’activité du
traceur à injecter est calculée en multipliant la masse du patient par
une constante A m=3,6 MBq·kg −1. La durée d’un tel examen est environ de deux heures.
3. Sachant qu’une
mole de traceur possède une activité A=63,4 GBq, montrer que la
quantité de matière n à injecter pour un patient de masse m=60 kg est
environ égale à 3,4×10 −3 mol.
3,6 x60 =216 MBq = 0,216 GBq.
0,216 / 63,4= 3,4×10−3 mol.
Le nombre N 0 de noyaux de fluor 18 initial dans la dose injectée est de 1,8×10 15. On modélise la désintégration de ces 1,8×10 15
noyaux par une fonction f qui au temps t, exprimé en minutes, associe
le nombre f't) de noyaux de fluor 18. On obtient la représentation de
la fonction f donnée dans le document suivant..
On rappelle que le temps de demi-vie, t ½, correspond à la durée au bout de laquelle la moitié des noyaux radioactifs initialement présents se sont désintégrés.
4. [Mathématiques] Résoudre graphiquement l’équation f(t)= 0,9×10 15 .
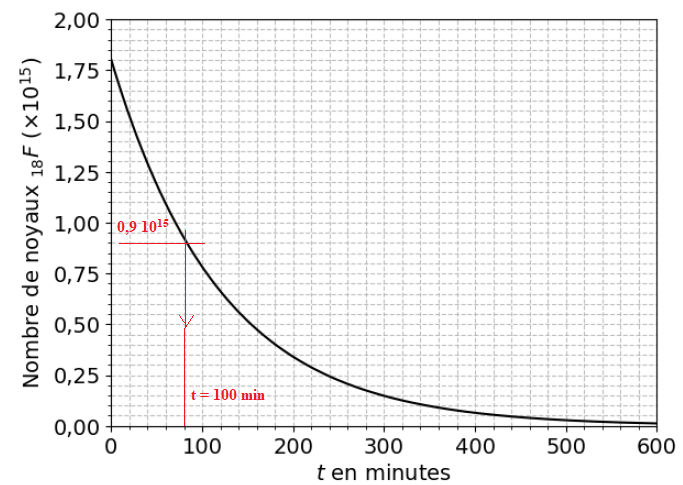
On admet que, pour tout réel 𝑡 positif, f(t)=1,8×1015×exp(-lt) , où l est un réel.
5. [Mathématiques] Résoudre algébriquement l’équation 0,9× 1015= 1,8× 1015× exp(-80x). On note l la solution de cette équation. Donner une valeur approchée de l à 10−4.
0,9 / 1,8 = exp(-80x) ; 0,5 = exp(-80 x) ;
ln(0,5) = -80 x ; ln(2) = 80 x ; x = ln(2) / 80 ~0,0087.
La relation entre la grandeur l et le temps de demi-vie t½ s’écrit : l=ln2/ t½.
6. Nommer la grandeur l.
Constant radioactive.
7. La valeur de la
demi-vie du carbone 11 est d’environ 20 minutes. À partir des résultats
obtenus à la question 4 et sachant que la durée d’un examen est
d’environ deux heures, expliquer pourquoi on peut être amené à
privilégier l’utilisation du fluor 18 pour certains examens.
Pour le fluor 18 la demi-vie est égale à ln(2) / 0,0087 ~80 min ou 1 h 20 min.
On privilégie le fluor 18 car sa demi vie est du même ordre de grandeur que la durée de l'examen.
Partie B : DANS LE DOMAINE DE LA CINÉTIQUE
La vitamine C, ou acide L-ascorbique, contribue au bon fonctionnement
de l’organisme. Présente dans les fruits et légumes frais, cette
vitamine est fragile et disparait rapidement après leur cueillette. En
l'absence de dioxygène, la dégradation de la vitamine C suit une
cinétique d'ordre 1.
On modélise la concentration en acide L-ascorbique dans un jus de fruit
par une fonction dérivable g qui, au temps t, exprimé en heures,
associe la concentration en acide L-ascorbique, exprimée en mmol·L−1. On note g′ la fonction dérivée de la fonction g.
On admet que, pour tout réel positif t, g(t)=2,5× exp( −0,0026 t). Une représentation graphique de la fonction g est présentée.
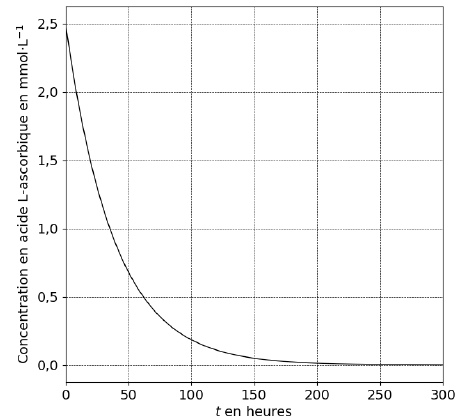
La vitesse de disparition vdisp de l’acide L-ascorbique est −dg / dt.
On admet que, pour tout réel t positif, la vitesse de disparition de l’acide L-ascorbique est donnée par
vdisp(t)=0,0065 exp(−0,0026 t).
8. [Mathématiques] Déterminer lla limite en +oo de vdisp(t).
Quand t tend vers +oo, exp(-0,0026t) tend vers zéro ; vdisp tend vers zéro.
9. Identifier le facteur cinétique expliquant que la vitesse de disparition de l’acide L-ascorbique tend vers 0.
La concentration en acide L-ascorbique diminue au cours du temps ; la concentration est un facteur cinétique.
On remarque que l’évolution de la concentration en acide L-ascorbique dans un jus de fruit au cours du temps à une température q inférieure à 25 °C suit l’allure de la courbe représentée sur le graphique ci-dessous.
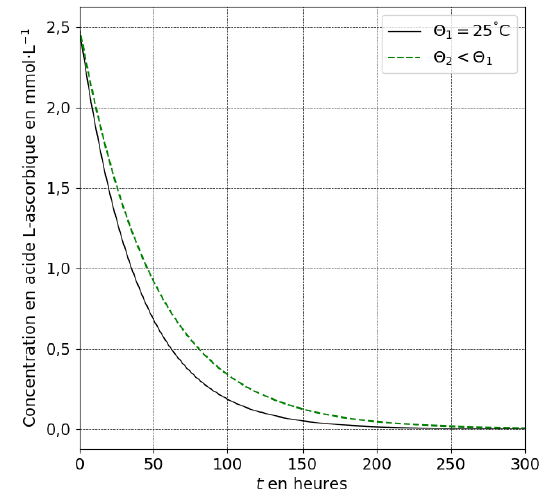
10. Déduire, de l’analyse de la figure, une technique courante pour conserver la teneur en vitamine C dans un jus de fruit.
Conserver le jus de fruit au réfrigérateur.
EXERCICE 2 (6,5 points)
(physique-chimie)
Les additifs alimentaires E280 et E281
Les additifs alimentaires E280 et E281 sont utilisés pour limiter
l’apparition des moisissures, par exemple dans certains fromages ou
pains industriels. L’additif E280 est l’acide propanoïque de formule C2H5−COOH, il est liquide à température ambiante. L’additif E281 est le propanoate de sodium de formule C2H5−COONa, qui lui se présente sous forme d’une poudre blanche à température ambiante.
Données : On admettra que toutes les mesures sont effectuées à 25 °C.
- Couple C2H5−COOH / C2⁄H5−COO− à 25 °C : Ka=1,35×10−5 et pKa=4,87
- Masse molaire du propanoate de sodium : M=96,0 g·mol−1
Une solution S d’acide propanoïque, de concentration en quantité de matière de soluté C=1,00×10−2 mol·L−1, a un pH mesuré de 3,44. L’acide propanoïque est un acide faible.
1. Écrire l’équation de la réaction de l’acide propanoïque avec l’eau.
C2H5−COOH aq + H2O(l) =C2⁄H5−COO− aq +H3O+aq.
2. Expliquer ce que signifie la phrase : « L’acide propanoïque est un acide faible. »
La réaction de cette acide avec l'eau est partielle.
3. Déterminer, entre C2H5−COOH(aq) et C2H5−COO−(aq),
l’espèce chimique prédominante dans la solution S. On pourra utiliser
un diagramme de prédominance pour justifier la réponse.
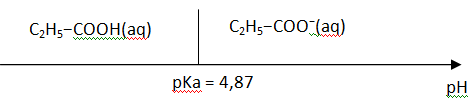
A pH < pKa, la forme acide C2H5−COOH(aq) prédomine.
4. Montrer que, dans la solution S, la concentration en quantité de matière en ion oxonium [H3O+(aq)] a pour valeur 3,63×10−4 mol·L−1.
[H3O+(aq)] = 10-pH = 10-3,44 =3,63×10−4 mol·L−1
5. À l’aide de
l’équation de la réaction de l’acide propanoïque avec l’eau, écrire la
relation entre la concentration en ions oxonium [H3O+(aq)] et la concentration en ions propanoate [C2H5COO− (aq)] dans la solution S.
La solution est électriquement neutre et à pH=3,44, HO- est négligeable.
[C2⁄H5−COO− aq]= [H3O+aq].
Le coefficient de dissociation a de l’acide propanoïque dans l’eau s’écrit : a= [C2H5COO− (aq)] / C
6. Montrer, en expliquant la démarche, que la valeur de ce coefficient est 0,0363.
Ka = [C2⁄H5−COO− aq] [ [H3O+aq] / [C2H5−COOH aq].
C = [C2H5−COOH aq]+ [C2⁄H5−COO− aq].
[C2⁄H5−COO− aq] << [C2H5−COOH aq].
C = [C2H5−COOH aq]
Ka ~[C2⁄H5−COO− aq] [H3O+aq] / C.= a [H3O+aq].
a =Ka / [H3O+aq] =1,35 10-5 / (3,63×10−4 )=0,0372.
7. Expliquer en quoi le résultat précédent confirme que l’acide propanoïque est un acide faible.
a <<1, l’acide propanoïque est un acide faible.
On dilue 10 fois la solution S. On obtient la solution S1 dont le pH est égal à 3,94.
8. Expliquer comment évolue la valeur du coefficient de dissociation a lorsque l’on dilue la solution S. Justifier la réponse avec ou sans calcul.
C2H5−COOH aq + H2O(l) =C2⁄H5−COO− aq +H3O+aq.
En diluant 10 fois la solution, on déplace l'équilibre dans le sens direct.
a =Ka / [H3O+aq] =1,35 10-5 / 10−3,94 =0,118.
On prélève 200 mL de la solution S. On pèse une masse égale à 0,192 g de propanoate de sodium C2H5−COO−,Na+
que l’on introduit dans la solution S et on agite. On néglige
l’augmentation de volume lors de l’ajout du propanoate de sodium. Le
mélange ainsi réalisé sera nommé S2. Le pH du mélange S2 est égal à 4,87. On réalise trois expériences en réalisant différents ajouts de solutions dans le mélange S2. Les résultats sont présentés.
Expérience 1 : ajout de 10 mL de solution d’acide chlorhydrique de concentration 1,0×10−2 mol·L−1 dans un volume v de S2
|
pH mesuré : 4,82
|
Expérience 2 : ajout de 50 mL d’eau distillée dans un volume v de S2
|
pH mesuré = 4,88
|
Expérience 3 : ajout de 10 mL de solution d’hydroxyde de sodium (base) de concentration
1,0×10−2 mol·L−1 dans un volume v de S2
|
pH mesuré = 4,91
|
9. Justifier que la solution est une solution tampon, en utilisant les résultats des trois expériences.
Lors de l'ajout modéré d'une base forte ou d'un acide fort, le pH de la
solution varie très peu. La solution S est une solution tampon.
10. En utilisant la relation suivante, pH=pKa+log[C2H5−COO − (aq) ] / [C2H5−COOH](aq)]
et les informations précédentes, déterminer une relation entre la
valeur de la concentration de l’acide propanoïque et celle de la
concentration de sa base conjuguée dans la solution S2.
log[C2H5−COO − (aq) ] / [C2H5−COOH](aq)]= pH-pKa = 4,87 -4,87 =0 = log(1).
.[C2H5−COO − (aq) ] = [C2H5−COOH](aq)].
|
...
= =
|
....
|
EXERCICE 3 (4 points)
(Mathématiques)
Dans cet exercice, les quatre questions sont indépendantes.
Il faut traiter les quatre questions.
Question 1
Soit f la fonction définie et dérivable sur R par f(x) = 3x +5+exp(x).
On note f ' la fonction dérivée de f.
Calculer f '(x).
f '(x) = 3 +exp(x).
.
Question 2
Résoudre dans ]0 ; +∞[ l'équation : 2ln(x)−1=7.
2 ln(x) =7+1=8 ; ln(x) = 4 ; x = exp(4).
Question 3
Soit le nombre T suivant : T=e −5×e 2.
En détaillant les calculs, écrire T sous la forme e n où n est un nombre entier relatif.
T = e -5+2= e -3.
Question 4
Soit g une fonction définie et dérivable sur R.
On admet que g est la solution de l'équation différentielle y′=0,2y+1 qui vérifie g(0)=3.
Parmi les quatre propositions ci-dessous, une seule est la bonne
réponse, recopier sur votre copie le numéro de la proposition qui vous
semble correspondre à celle de la fonction g.
Solution générale de y'-0,2y =0 : g(x) = A exp(0,2x) avec A une constante réelle
Solution particulière de y' -0,2y =1 : f(x) = -5.
Solution générale de y′=0,2y+1 :
g(x) = A exp(0,2x) -5.
g(0) = A-5 =3 ; A = 8.
g(x) = 8 exp(0,2x)-5. Réponse 2.
EXERCICE 4 : Toujours plus haut ! (4 points)
(physique-chimie)
Le 5 août 2024, au cours des Jeux olympiques de Paris, le Suédois,
Armand Duplantis, a battu le record du monde du saut à la perche avec
un saut à 𝟔,𝟐𝟔 𝐦.
Le principe du saut à la perche repose sur la conversion de l’énergie
cinétique, issue de la course d’élan du perchiste, en énergie
potentielle de pesanteur. Lorsque le sauteur plante la perche en bas du
sautoir, il tord cette dernière grâce à son énergie cinétique. Lorsque
la perche se détend, elle restitue cette énergie à l’athlète, ce qui
lui permet de s’élever dans les airs. Aujourd’hui, une perche en fibre
de carbone restitue intégralement l’énergie que lui apporte le sauteur.
Dans les faits, un perchiste de très haut niveau, de masse 80 kg, se
présentant avec une vitesse de 36 km/h (10 m/s) amène une énergie de 4
000 joules à sa perche. La marge principale de progression d’un
sauteur, c’est sa vitesse de course, d’où l’émergence des sauteurs
comme Lavillenie (10,9 s au 100 m) et Duplantis (10,5 s).
D’après un article :
https://www.ouest-france.fr/sport/athletisme/athletisme-les-records-du-monde-de-duplantis-c-est-toute-une-science-6749142
Le système « perchiste » est modélisé par son centre de gravité, point
matériel noté G situé initialement à une altitude h=1,0 m du sol. Son
mouvement est étudié dans le référentiel terrestre. L’origine des
altitudes est prise au niveau du sol et l’axe est orienté vers le haut.
Donnée : intensité de la pesanteur g=9,8 m·s −2.
Première phase : course d’élan
1. Écrire l’expression de l’énergie cinétique Ec d’un corps de masse m et de vitesse v. Les unités seront précisées.
Ec = ½mv2.
Ec en joule ; m en kg et v en m /s.
Dans la suite de l’exercice, on s’intéresse au cas du perchiste de très haut niveau évoqué dans l’article ci-dessus.
2. Vérifier
que l’énergie cinétique Ec acquise par le perchiste lors de sa course
d’élan correspond bien à « l’énergie de 4 000 J » apportée à la perche.
Ec = 0,5 x80 x10 2=4 000 J.
D euxième phase : mouvement ascensionnel du perchiste
Dans cette phase, on ne tiendra pas compte de la perche.
3. Expliquer quel est le transfert énergétique mis en jeu pour le perchiste au cours de cette phase.
Transfert d'énergie cinétique en énergie potentielle de pesanteur.
4. Montrer que la valeur de l’énergie mécanique E 1 du point G lorsque le perchiste quitte le sol est d’environ 4 800 J.
E 1 = mgh + ½mv 2 =80 x9,8 x1+4000~4800 J.
5. Écrire l’expression littérale de l’énergie mécanique E 2 du perchiste au sommet de sa trajectoire. L’altitude du point G est notée h 2 et sa vitesse est considérée comme nulle à cette hauteur.
6. En
utilisant la conservation de l’énergie mécanique lors du saut, montrer
que la hauteur théoriquement franchie par le perchiste, notée h max, est environ égale à 6 m.
Au point le plus haut, la vitesse est nulle.
La conservation de l'énergie mécanique conduit à : 4800 = mg h max ; h max = 4800 /(80 x9,8) ~ 6,1 m.
7. Expliquer ce qui a pu permettre à Armand Duplantis de dépasser une hauteur de 6 m.
Armand Duplantis a augmenter sa vitesse de course.
|
|
|
|
|