Partie 1 - Extraction du lithium Après
avoir fait réagir une saumure avec du carbonate de sodium et filtré le
mélange, un industriel souhaite savoir si l'objectif de récupérer 90 %
du lithium présent est atteint.
Un volume V=200,0 mL d'une solution S est préparée en diluant au centième le filtrat obtenu. Un volume V
1 = 5,0 mL de la solution S est titré par pHmétrie avec une solution d'acide chlorhydrique de concentration c
2 = 1,00 10
-2 mol / L.
Q1 - Donner la liste de la verrerie à utiliser pour préparer la solution S par dilution du filtrat.
Fiole jaugée de 200 mL ; pipette jaugée de 2,00 mL ; becher, pissette d'eau distillée.
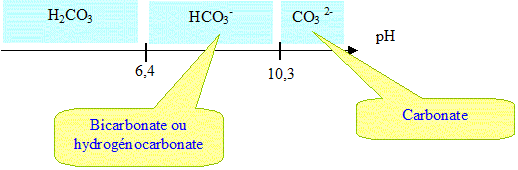
Q2- Tracer le diagramme de prédominance des espèces acido-basiques H
2CO
3 aq, HCO
3-aq et CO
32-aq.
 Q3-
Q3- Indiquer l'espèce prédominante présente initialement dans la solution titrée sachant que son pH initial est égal à 11,4.
A pH 11,4, la forme CO
32- prédomine.
Q4. Préciser en justifiant si cette espèce est un acide, une base ou un ampholyte.
CO32- est une base.
Equation de la réaction support du titrage : CO
32-aq +2H
3O
+aq --> H
2CO
3aq + 2H
2O(l).
Volume de la solution titrée versé à l'équivalence Ve=15,2 mL.
Q5. Définir l'équivalence d'un titrage.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques.
Q6. Donner la
relation entre la quantité de matière initiale des ions carbonate et la
quantité de matière des ion oxonium versée à l'équivalence.
n(
H3O+)=2n (
CO32--) .
Q7. L'objectif d'extraction du lithium de la saumure est-il atteint ?
n ( CO32-) = 0,5 x Ve xc2=0,5 x15,,2 x 0,0100 =0,076 mmol dans 5 mL.
0,076 / 5 = 0,0152 mol / L
Tenir compte de la dilution au centième : 0,0152 x100 = 1,52 mol / L.
M( CO32-) = 60,0 g /mol ;
60,0 x1,52 =91,2 g / L.
Cette valeur étant supérieure à 60 g / L, l'objectif d'extraction du lithium de la saumure est atteint.