fiche bac
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
| .
. |
Oxydant :
Un oxydant est une espèce chimique capable de gagner un ou plusieurs électron(s).
Réducteur :
Un réducteur est une espèce chimique capable de céder un ou plusieurs électron(s).
Couple oxydant / réducteur : couple redox
Un couple oxydant / réducteur est formé d'un oxydant et d'un réducteur tels que :
Réaction d'oxydoréduction :
C'est une réaction au cours de laquelle deux couples rédox échangent un ou plusieurs électron(s).
Soit les couples ox1/red1 et ox2/red2. L'oxydant le plus fort ox1 oxyde le réducteur le plus fort (red2).
red2 = ox2 + n2e- ( fois n1 ) oxydation
dans le bilan les électrons n'apparaissent pas, oxydation et réduction sont simultanées
n2 ox1 + n1 red2 --> n2 red1 + n1 ox2 oxydo réduction.
exemple :
MnO4-(aq) + 8H+(aq) + 5e- = Mn2+(aq) + 4H2O
5 fois { Fe2+(aq) = Fe3+(aq) + e-}
5Fe2+(aq) + MnO4- (aq) +8H+(aq) --> 5Fe3+(aq) + Mn2+(aq) + 4H2O
Transformation rapide :
On dit qu'une transformation est rapide si elle se fait en une durée trop courte pour que son évolution puisse être suivie "à l'oeil nu" ou avec les appareils de mesure courants ( pHmètre conductimètre spectrophotomètre)
Transformation lentes :
C'est une transformation dont l'évolution peut être suivie "à l'oeil nu" ou avec les appareils de mesure courants pendant plusieurs minutes.
Facteurs cinétiques :
- Un facteur cinétique (température, concentrations des réactifs, catalyseurs ) est une grandeur qui modifie la durée ( donc la vitesse) d'une transformation chimique.
- Plus la température du milieu réactionnel est élevée, plus la transformation est rapide. Inversement plus la température du milieu est basse plus la transformation est lente.
- Plus les concentrations initiales des réactifs
sont élevées plus la transformation est
rapide.
- si un réactif est un solide, la vitesse est d'autant plus grande que la surface du solide est grande . - Un catalyseur augmente ( quelque fois oriente quand
deux issues sont possible) la vitesse d'une
réaction.
Vitesse volumique de réaction :
v: vitesse volumique de réaction (en mol.m-3.s-1)
V: volume de la solution (en m3)
dx: variation de l'avancement x (en mol)
dt: durée de la variation (en s)
Le rapport dx/dt représente la dérivée par rapport au temps de l'avancement.
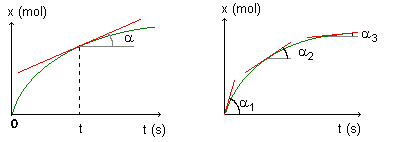
On trace la tangente à la courbe x=f(t) à la date t choisie. La valeur du rapport dx/dt est égal au coefficient directeur de cette tangente.
On divise alors cette valeur par la valeur de V (volume de la solution) pour obtenir la vitesse.
Evolution de la vitesse de réaction au cours du temps :
Au cours du temps les réactifs disparaissent, en conséquence leur concentration diminue. Or la concentration des réactifs est un facteur cinétique. Plus la concentration des réactifs est faible plus la réaction est lente.
Temps de demi-réaction :
Le temps de demi-réaction t½ est la durée au bout de laquelle l'avancement x est égal à la moitié de l'avancement final. L'avancement final est souvent déterminé par une mesure du pH ou par une mesure de la conductivité )
Si la transformation est totale,(disparition du réactif limitant ), l'avancement final est égal à l'avancement maximal.
Méthodes utilisées en cinétique chimique : méthodes permettant de suivre l'évolution d'une transformation chimique.
- Conductimétrie : pour les milieux réactionnels contenant des ions subissant une transformation, la mesure de la conductivité permet d'accéder à la concentration de ces ions. ( aux faibles concentrations, conductivité et concentrations des ions sont proportionnelles).
- pH-métrie : pour les milieux réactionnels contenant des ions oxonium H+(aq) ou H3O+ subissant une transformation, la mesure du pH donne accès à la concentration de ces ions.
- Mesure du volume ou de la pression lorsqu'un gaz est mis en jeu.
- Spectrophotométrie : utilisée lorsque l'une des espèces mises en jeu (réactif ou produit) est colorée.
Le spectrophotomètre fait passer une radiation (lumière) monochromatique (une seule longueur d'onde) à travers une longueur l (longueur de la cuve du spectrophotomètre) de solution et mesure l'absorbance A (grandeur liée à la quantité de lumière absorbée par la solution). La loi de Beer-Lambert indique que l'absorbance A et la concentration sont proportionnelles :
A : absorbance de la solution (sans unité)
C : concentration de la solution (en mol.L-1)
Le pH et sa mesure :
Le caractère acide d'une solution aqueuse est dû à la présence des ions oxonium H3O+ dans cette solution. Le pH se mesure à l'aide d'un pH-mètre.
la concentration en ions oxonium est exprimée en mol.L-1.
à 25°C, la neutralité acido-basique correspond à pH=7,0, que les solutions acides ont un pH < 7,0 et que les solutions basiques ont un pH > 7,0.
acide : espèce, ion ou molécule susceptible de céder un proton H+.
base : espèce, ion ou molécule susceptible de gagner un proton .
couple acide base noté AH/ A- : entre l 'acide et la base conjuguée existe l'équilibre
AH = A- + H+ caractérisé par la constante d'acidité Ka = [A-][H+] / [AH]
cette relation s'écrit : pH= pKa + log ( [A-] / [AH] )
réaction du chlorure d'hydrogène HCl avec l'eau :
Observation expérimentale : le pH d'une solution aqueuse de chlorure d'hydrogène (ou acide chlorhydrique) de concentration molaire C =0,01 mol.L-1 est égal à 2.
- La réaction est totale. L'avancement final est égal à l'avancement maximum. Un tel acide est appelé acide fort.
- Le taux d'avancement final de la réaction défini par la relation ci-dessous vaut t =1
- pH = -log C avec ( 5 10-2 > C >10-6 mol/L )
Réaction de l'acide éthanoïque avec l'eau :
Observation expérimentale : le pH d'une solution (1 L) d'acide éthanoïque (ou acide acétique) de concentration c=0,01 mol.L-1 est égal à 3,4.
- La réaction n'est pas totale car n(CH3-COO-)fin < n(CH3-COO-)max.
- Le taux d'avancement final est inférieur à 1. Un tel acide est appelé acide faible.
solution électriquement neutre :[CH3-COO-]fin=[H3O+]
xfin = 10-pH = 10-3,4 = 4 10-4 mol
t =4 10-4 / 0,01 = 0,04
Écriture de l'équation d'une réaction réversible : ( qui peut s'effectuer dans les deux sens)
Lorsqu'une réaction est réversible la flèche est remplacée par un signe = On écrit
On dit q'un système chimique, siège d'une transformation possible, est en équilibre si les concentrations (ou les quantités de matière) de ses constituants restent constantes au cours du temps.
à l'équilibre précédent, on associe une constante K qui ne dépend que de la température :
dans l'expression de K, on n'écrit ni le solvant, l'eau,ni les espèces solides. Au numérateur se trouvent les concentrations des produits ; au dénominateur celles des réactifs.
Les concentrations s'expriment en mol / L.
K = [CH3-COO-][H3O+] / [CH3-COOH]
La catalyse est l'action d'un catalyseur sur une transformation chimique.
Catalyseur : un catalyseur est une espèce qui augmente la vitesse d'une transformation, sans figurer dans l'équation de la réaction et sans modifier la composition du système à l'état final.
Catalyse homogène : on dit d'une catalyse qu'elle est homogène si le catalyseur et les réactifs ne forment qu'une seule phase.
La réaction de décomposition (dismutation) de l'eau oxygénée (ou peroxyde d'hydrogène: H2O2) peut être catalysée par les ions fer (III) en solution aqueuse. Il n' y a qu'une seule phase, la phase aqueuse.
Catalyse hétérogène : on dit d'une catalyse qu'elle est hétérogène si le catalyseur et les réactifs forment plusieurs phases.
La réaction de synthèse de l'eau à partir du dihydrogène et du dioxygène peut être catalysée par le platine solide (mousse de platine). Les réactifs sont en phase gazeuse et le catalyseur est en phase solide.
Catalyse enzymatique : le catalyseur est une enzyme, c'est-à-dire une protéine élaborée par un organisme vivant. Cette catalyse s'apparente à la fois à une catalyse homogène (le catalyseur et les réactifs du milieu biologique ne forment qu'une seule phase aqueuse) et à une catalyse hétérogène (par le mode d'action (présence de site actif)).
Un catalyseur a un rôle purement cinétique. Cela signifie qu'il ne peut accélérer qu'une réaction qui peut avoir lieu sans lui. Il ne modifie ni le sens d'évolution d'une transformation ni la composition du système à l'état final.
Un catalyseur est sélectif si son action est spécifique. Cela signifie qu'un système peut évoluer différemment selon le catalyseur utilisé, ou encore, qu'un catalyseur peut orienter une transformation chimique. L'évolution de l'éthanol lors de son chauffage dépend du catalyseur utilisé.
En présence de cuivre (catalyseur), l'éthanol subit une déshydrogénation pour donner de l'éthanal.
En présence d'alumine (oxyde d'aluminium Al2O3) il subit une déshydratation pour donner de l'éthylène.