|
chimie bac :
transformation lente ou rapide
cinétique
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
fiche
bac
|
|
Oxydation des ions
iodures
A) Préparation des solutions :
- Quelle masse de peroxodisulfate d'ammonium
(NH4)2S2O8
faut il utiliser pour préparer 100 mL de solution
S de concentration 0,1 mol/L ?
- On dispose d'eau distillée, de la verrerie du
laboratoire et d'une solution d'iodure de potassium
(K+ + I-.) de concentration C,
égale à 1 mol/L. Quelle volume de cette
solution faut il utiliser pour obtenir 100 mL d'une
solution S' d'iodure de potassium de concentration 0,2
mol / L ?
- Expliquer la méthode de préparation en
précisant le matériel utilisé ?
B) Etude de la réaction
- A l'instant t=0 on réalise le mélange M
de 100 mL de solution S et de 100 mL de la solution S'.
La réaction lente qui se produit a pour
équation :
S2O82-+2I--->2
SO42- + I2
- Quelle est à t=0, la concentration molaire
volumique en S2O82-
notée [S2O82-
]0 dans le mélange
réalisé ?
- On prélève, à différentes
dates t, un volume V1 égale à 10
mL du mélange M que l'on refroidit
immédiatement dans l'eau glacée. Dans
chacun des prélèvements, on dose le diiode
I2 formé par une solution de
thiosulfate de sodium (2Na+,
S2O32-) de concentration
C2=0,01 mol/L, en présence d'empois
d'amidon. La réaction rapide et totale du dosage
à pour équation : I2 +
2S2O32- -->
2I-. + S4O62-
. Dans le tableau ci après, on a regroupé
les différentes valeurs V2 du volume de
solution de thiosulfate de sodium nécessaire au
dosage des différents
prélèvements.T(min)
|
T(min)
|
0
|
4,5
|
8
|
16
|
20
|
25
|
30
|
36
|
44
|
54
|
59
|
|
V2 (mL)
|
0
|
1,8
|
2,4
|
4
|
4,8
|
5,6
|
6,1
|
6,9
|
7,4
|
8,4
|
9,2
|
|
[I2](.10-2)
(mol/L)
|
|
|
|
|
|
|
|
|
|
|
|
-Pourquoi prend-on la précaution de refroidir le
prélèvement ?
- Exprimer la relation entre la quantité de diiode
I2 noté n(I2),
présent dans le prélèvement et la
quantité d'ions thiosulfate
S2O32- notée
n(S2O32- )
nécessaire à son usage.
-En déduire, en fonction de C2,
V1 et V2 la relation donnant la
concentration [I2 ] de diiode contenu
dans chaque prélèvement du volume
V1.
- Tracer le graphe [I2 (t)] =
f(t).
- Définir la vitesse volumique de la
réaction
- Déterminer les valeurs de cette vitesse aux
dates t=20 min et t=40 min.
- Expliquer comment varie la vitesse de réaction
au cours du temps.
corrigé
masse molaire
(NH4)2S2O8 :
228g/mol
Qté de matière : 22,8/228 = 0,1 mol dans 1L
soit 2,28 g dans 0,1 L.
facteur de dilution : 1 / 0,2 = 5
donc pipette (+ pipeteur) de 20
mL et fiole jaugée de 100 mL :
compléter avec de l'eau distillée jusqu'au
trait de jauge.
[S2O82-] = 0,1 /
2 = 0,05 mol/L car le volume
dumélange M est le double du volume de la solution
initiale S.
trempe ou blocage cinétique : arrêt de la
réaction entre les ions
S2O82- et les ions iodures
ce qui nous laisse le temps de doser le diiode
formé.
2S2O32- + I2
-->
2S4O62-+2I-
|
2S2O32-
ajouté à la burette
|
diiode
|
|
t=0
|
0
|
n
|
|
t
|
2x= C2V
|
n-x
|
|
équivalence
|
2xéqui=
C2V2
|
n-xéqui =0
|
n= ½C2V2 dans V1 mL
issu du mélange M
[I2]=½C2V2
/ V1=5 10-3 V2/10 =
5 10-4
V2.
|
T(min)
|
0
|
4,5
|
8
|
16
|
20
|
25
|
30
|
36
|
44
|
54
|
59
|
|
V2 (mL)
|
0
|
1,8
|
2,4
|
4
|
4,8
|
5,6
|
6,1
|
6,9
|
7,4
|
8,4
|
9,2
|
|
[I2](.10-2)
(mol/L)
|
0
|
0,09
|
0,12
|
0,2
|
0,24
|
0,28
|
0,305
|
0,345
|
0,37
|
0,42
|
0,46
|
|
S2O82-
|
+2I-
|
2 SO42-
|
diiode
|
|
t=0
|
0,01 mol
|
0,02 mol
|
0
|
0
|
|
t
|
0,01-x
|
0,02-2x
|
2x
|
x
|
vitesse v = 1/V dx/dt = d[I2]/dt car
[I2] = x/V avec V= 0,2 L, volume du
mélange.
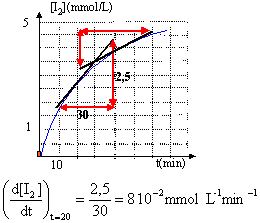
un calcul identique à t =40 min conduit à
environ 2 10-2 mmol
L-1min-1.
la vitesse diminue au cours du temps car les
concentrations des réactifs diminuent ( tangentes
à la courbe ci-dessus moins inclinées sur
l'horizontale)
|
|
éthanol et acide
propanoïque :
On prépare un mélange équimolaire
d'éthanol et d'acide éthanoïque. On place
une même quantité de ce mélange dans
douze tubes scellés, placés dans une enceinte
où règne une température constante.
Pour la moitié de ces tubes, le mélange
contient une goutte d'acide sulfurique concentré qui
apporte des ions H3O+. Entre ces deux
réactifs, se produit la réaction
d'équation :
C2H5OH +
CH3CO2H =
CH3CO2C2H5 +
H2O où
CH3CO2C2H5 est
un ester.
- On désire connaître la quantité n
de moles d'ester formée. Pour cela, à des
dates précisées dans le tableau ci-dessous,
on retire, un par un, chacun des tubes que l'on refroidit
aussitôt.
|
T(h)
|
0
|
1
|
3
|
6
|
9
|
12
|
15
|
|
n(mol) sans H3O+
expérience 1
|
0
|
0,12
|
0,23
|
0,33
|
0,37
|
0,39
|
0,41
|
|
n(mol) avec H3O+
expérience 2
|
0
|
0,47
|
0,64
|
0,65
|
0,66
|
0,66
|
0,66
|
-Quel est le but de ce refroidissement ?
-Si on appelle na le nombre de moles d'acide
présent au départ dans chaque tube, comment
détermine t-on expérimentalement le nombre
n de moles d'ester formé dans les tubes ne
contenant pas l'acide sulfurique ?
- Tracer, dans le même système d'axes, les
courbes n=f(t) pour chacune des deux expériences.
Utiliser l'échelle de représentation
suivante : 1cm pour 1 h en abscisse et 1 cm pour 0,05
mole en ordonnée.
- La vitesse de réaction à un instant t
est définie par la relation : v(t) = dn(t) /
dt.
- Comment à une date t, obtient-on la vitesse v
à partir du graphique n=f(t) ?
-Evaluer graphiquement, pour chaque expérience,
l'ordre de grandeur de la vitesse volumique de
réaction au démarrage de la réaction
d'estérification ( à l'instant t=0).
-Dans la seconde expérience, quelle est la valeur
de la vitesse volumique de réaction à la
date t=15h ?
corrigé
trempe ou blocage cinétique : arrêt de
la réaction entre l'alcool et l'acide
éthanoïque ce qui nous laisse le temps de doser
l'acide restant.
|
alcool
|
acide éthanoïque
|
ester
|
|
t=0
|
n
|
n
|
0
|
|
en cours
|
n-x
|
n-x
|
x
|
|
fin
|
n-xfin
|
n-xfin
|
xfin
|
doser l'acide éthanoïque restant à
chaque heure par une solution de soude.
faire la différence avec la quantité
initiale d'acide éthanoïque pour trouver la
qté d'ester formé (exp 1).
vitesse v = 1/V dx/dt
tracer la tangente à la courbe ci-dessous à
la date donnée pour obtenir dx/dt
puis diviser par le volume V de la solution pour obtenir
la vitesse
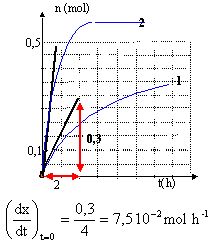
exp2 : [dx/dt]t=0 = 0,5/1
= 0,5 mol h-1.
à t =15 h ( exp 2) la tangente étant
horizontale, alors la vitesse est nulle (la composition du
mélange n'évolue plus).
|
|
cinétique par suivi de la
pression :
Une solution d'acide chlothydrique
H3O+ (aq) + Cl- (aq), agit
sur le carbone de calcium solide CaCO3(s), avec
formation de dioxyde de carbone gazeux CO2 (g) et
de chlorure de calcium en solution Ca2+ (aq) + 2
Cl- (aq).
On introduit un excès de carbonate de calcium dans
un volume Va=50,0 mL d'acide chlorhydrique, de concentration
de soluté apporté égale à 0,04
mol/L. On suit l'évolution du système chimique
par mesure du volume de dioxyde de carbone produit, à
pression et à température constante.
- Ecrire l'équation de la réduction.
- Exprimer dx/dt, la dérivée de
l'avancement chimique par rapport au temps, en fonction
du volume V de dioxyde de carbone produit.
- A différents instants, on mesure le volume de
CO2 (g) dégagé. On obtient le
tableau des mesures suivant
|
T(s)
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
100
|
|
V(mL)
|
2,5
|
4,56
|
6,64
|
8,24
|
9,76
|
11,12
|
12,18
|
13,08
|
13,88
|
14,34
|
- tracer la courbe V=f(t) Echelle 1 cm pour 10 s et 1 cm
pour 10 mL.
- A partir de la courbe obtenue, déterminer la
vitesse de réaction v=(1/Va).(dx/dt) à la
date t1=50s.
- Une autre méthode consiste à suivre
l'évolution temporelle de la concentration en ion
oxonium [H3O+] On obtient
les valeurs suivantes :
|
T(s)
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
90
|
100
|
|
[H3O+]
(mol/L)
|
0,036
|
0,032
|
0,028
|
0,025
|
0,023
|
0,020
|
0,018
|
0,017
|
0,015
|
0,014
|
- Exprimer la vitesse de réaction v=(1/Va).(dx/dt)
en fonction de [H3O+]
-Tracer la courbe représentant les variations de
[H3O+] en fonction du temps
- A partir de cette seconde courbe, déterminer la
vitesse de réaction à la date
t1=50s.
- Comparer les valeurs des vitesses de réaction
obtenues par les deux méthodes.
Données :
volume molaire des gaz dans les condition de
l'expérience Vm=22,4 L/mol.
corrigé
CaCO3(s) + 2H3O+
--> Ca2+ + CO2(g) +
3H2O
|
CaCO3(s)
|
2H3O+
|
CO2(g)
|
|
t=0
|
n
|
2 10-3 mol
|
0
|
|
t
|
n-x
|
2 10-3 -2x
|
x
|
|
fin
|
n-xmax
|
2 10-3
-2xmax=0
|
xmax =10-3
mol
|
x mol CO2 soit un volume V= 22,4 x litres.
dériver par rapport au temps : dV/dt = 22,4
dx/dt
ou dx/dt = 1/22,4 dV/dt =4,46 10-2 dV/dt
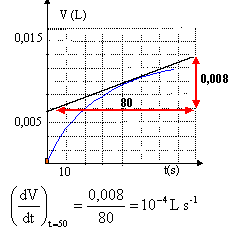
(dx/dt )t=50s=4,46
10-2*10-4 = 4,4 10-6 mol
s-1.
vitesse = 1/Va (dx/dt )t=50s=4,4
10-6 / 0,05 = 8,8
10-5 mol L-1s-1.
[H3O+]=(2 10-3 -2x)
/ Va
d[H3O+] / dt= -2/ Va dx/dt
soit v = 1/Va (dx/dt ) = -½
d[H3O+] / dt
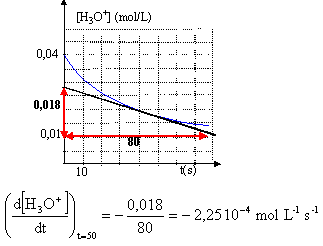
vitesse = -½ *(-2,25 10-4) =
1,1 10-4 mol
L-1s-1.
valeur du même ordre de grandeur que la valeur
précédente, compte tenu du fait de
l'imprécision du tracé des tangentes.
|
|
décomposition de l'eau
oxygénée
Une solution d'eau oxygénée se
décompose très lentement selon la
réaction : H2O2 (aq) -->
H2O (l) + ½ O2 (g).
L'étude de la décomposition d'un volume
égal à 0,50 L d'une solution d'eau
oxygénée de concentration 9,00 mol/L a
montré que, sur l'intervalle de temps
[0-10h], l'avancement de la réaction
était pratiquement proportionnel au temps selon la
relation x=3.10-5t (x en mol et t en h).
- Exprimer la vitesse de réaction en fonction de
l'avancement de la réaction.
- Calculer cette vitesse sur l'intervalle de temps
considéré.
- Montrer que la concentration de la solution en eau
oxygénée peut être
considérée comme constante lors de cette
expérience.
- Pourquoi assimile-t-on la vitesse de réaction
calculée à la vitesse de réaction
initiale ?
corrigé
x=3.10-5t d'où dx/dt
=3.10-5
vitesse = 1/V dx/dt =1/0,5 dx/dt = 2 dx/dt =
6 10-5mol
L-1s-1.
la vitesse est constante sur l'intervalle [0 ; 10
h]
à t=10 h l'avancement vaut x10
=3.10-4 mol
la concentration initiale d'eau oxygénée
était 9 mol/L soit 4,5 mol dans 0,5 L; x10
est négligeable devant 4,5 mol
la concentration en eau oxygénée est donc
constante sur ce intervalle [0 ; 10 h]
|
|
En présence d'eau, le sacchoarose se transforme en
glucose et en fructose, selon la réaction :
C12H22O11 (aq) +
H2O (l) ---- >
C6H12O6 (aq) +
C6H12O6 (aq)
- Les formules semi-développées du
glucose et du fructose sont respectivement :
CH2OH-CHOH-CHOH-CHOH-CHOH-CHO et
CH2OH-CO-CHOH-CHOH-CHOH-CH2OH.
- Indiquer les groupes caractéristiques
présents dans ces molécules.
- Comment qualifie t-on des espèces chimiques
telles que le fructose et glucose, qui ont la même
formule brute ?
- On part d'une solution de volume 100 mL contenant
34,2 g de saccharose et on détermine la
concentration c du glucose à différentes
dates (tableau ci-dessous)
|
T (min)
|
0
|
40
|
80
|
120
|
160
|
190
|
220
|
|
C (mol/L)
|
0
|
0,135
|
0,25
|
0,35
|
0,44
|
0,5
|
0,55
|
- Calculer l'avancement de la réaction à
ces différentes dates.
- Montrer que la réaction n'est pas
terminée au bout de 220 min.
- Déterminer le temps de demi -
réaction.
Données : Mc=12,0g/mol Mo=16,0 g/mol MH=1,0
g/mol
corrigé
le glucose contient une fonction aldehyde -CHO, une
fonction alcool primaire -CH2OH
et 4 fonctions alcool secondaire -CHOH-
le fructose contient une fonction cétone -CO-,
deux fonctions alcool primaire -CH2OH
et 3 fonctions alcool secondaire -CHOH-
glucose et fructose sont deux isomères
|
saccharose
|
glucose
|
|
initial
|
34,2 / 342 =0,1 mol
|
0
|
|
en cours
|
0,1-x
|
x
|
|
fin
|
0
|
0,1 mol
|
[glucose]= x/V = x/0,1 = 10 x d'où x =
0,1[glucose] = 0,1 C
|
T (min)
|
0
|
40
|
80
|
120
|
160
|
190
|
220
|
|
C (mol/L)
|
0
|
0,135
|
0,25
|
0,35
|
0,44
|
0,5
|
0,55
|
|
x (mol)
|
0
|
0,0135
|
0,025
|
0,035
|
0,044
|
0,05
|
0,055
|
lorsque la réaction, supposée totale est
terminée, l'avancement est égal à 0,1
mol
à t=220 min celle-ci est loin d'être
terminée.
t½ est la durée au bout de laquelle
l'avancement est égal à la moitié de
l'avancement final.
si la réaction est totale
xfin=xmax=0,1 mol
donc x½ = 0,05 mol et t½ = 190 min ( lecture
tableau)
retour
- menu
|
|