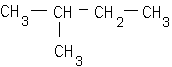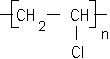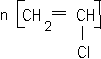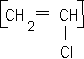| .
. |
||||||||||||||||||||||||
|
BTS batiment (2000) |
||||||||||||||||||||||||
|
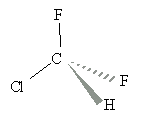
I étude d'un polymère : le polytétrafluoroéthène : 6 points Le PTFE est un polymère remarquable par ses propriétés de résistance aux acides et aux bases, ainsi qu'à beaucoup de solvants. Préparation du monomère : Le monomère du PTFE est le tétrafluoroéthène de formule brute C2F4.
Données: Masses molaires (en g. mol-1) : C=12; F=19, CI=35,5 ; H= 1 Etude de la macromolécule. La macromolécule de polytétrafluoroéthène s'écrit : 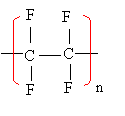 1) Le motif du PTFE : 2) Calculer le nombre de motifs pour une macromolécule ayant une masse moyenne de 106 g. mol-1. corrigé |
||||||||||||||||||||||||
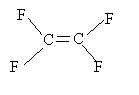
La molécule posséde une liaison double carbone carbone: de telles molécules peuvent subir assez facilement des réactions d'addition. La nouvelle molécule ( après addition ) posséde encore une liaison double C=C, une nouvelle addition peut donc se produire et ainsi de suite.
2 CF2HCl --> C2F4 + 2HCl masse molaire de C2F4 : 2*12+4*19 = 100 g/mol Quantité de matière de C2F4 dans une tonne ou 106 g : masse (g) / masse molaire (g/mol) = 106 / 100 = 104 mol d'après les coefficients de l'équation ci dessus: 2 mol de CF2HCl conduisent à 1 mol C2F4 2 104 mol de CF2HCl conduisent à 104 mol C2F4 masse molaire CF2HCl : 12+1+2*19+35,5 = 86,5 g/mol masse de CF2HCl : 86,5 * 2 104 = 1,73 106 g = 1,73 tonnes. masse molaire du motif : 2*12+4*19 = 100g/mol le nombre n est l'indice de polymérisation ou nombre de motifs qui ont conduit à la macromolécule. n=106 / 100 = 10000 motifs.
|
||||||||||||||||||||||||
|
II QCM une seule bonne réponse par question 6 points
corrigé C2H4 : éthylène masse molaire 28 g/mol. 2-méthylbutane masse molaire du monomère : 105 000 / 2500 = 42 g/mol le PVC :
si acide fort : pH= -log C = -log 0,5 = 0,3 il s'agit d'un acide faible si la mesure indique pH=2,6. la dernière colonne du tableau est correcte.
retour - menu |