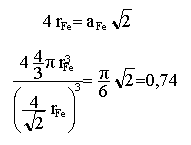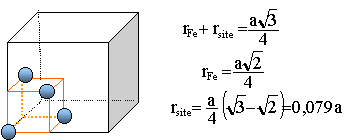|
.
. |
système cubique à faces centrées En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||
|
|
|
|||||
|
alliage cuivre argent |
Le cuivre cristallise dans le système cubique à faces centrées.
N=6,02 1023 mol-1. rCu=8920 kg m-3. Ag=107,9 g mol-1. Cu=63,5 g mol-1. rAg=144 ppm. corrigé |
|||||
|
|
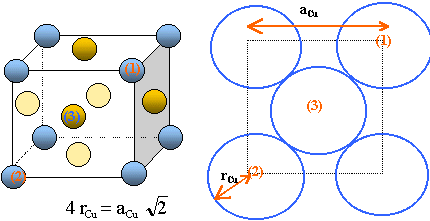
les atomes tangents sont situés sur la diagonale de chaque face. masse d'un atome de cuivre : MCu / N. la maille contient 4 atomes de cuivre en propre. (chaque atome situé sur un sommet du cube appartient à 8 mailles et compte pour 1 / 8 ; chaque atome situé au centre d'une face appartient à 2 mailles) et compte pour 1 / 2. volume du cube : a3Cu. masse volumique : rCu = 4 MCu / (Na3Cu) d'où rCu=127,9 pm plan réticulaire : plan passant par au moins trois noeuds ( il existe une infinité de plans réticulaires) Sur la diagonale d'une face on trouve 3 atomes tangents. d'où aAg=407,3 pm masse volumique de l'argent : la maille contient 4 atomes d'argent en propre. volume du cube : a3Ag. rAg = 4 MAg / (Na3Ag) = 10610 kg m-3. Sur la diagonale d'une face on trouve la séquence : Ag Cu Ag 1,414 a' =2(rAg+rCu) soit a' = 384,5 pm La masse d'une maille est la somme des masses des atomes d'argent et de cuivre contenus dans celle ci soit en propre (1 argent sur les sommets et 3 cuivre aux centres des faces). titre massique en argent : 100*MAg /(MAg+3MCu) = 36,1%.
|
|||||
|
le fer g |
Le fer g cristallise dans une structure cubique à faces centrées de paramètre a.
N=6,02 1023 mol-1.. Fe=55,8 g mol-1. corrigé |
|||||
|
|
coordinence = 12, nombre de plus proches voisins. La maille contient en propre 4 atomes. Suivant une diagonale 3 atomes sont tangents. compacité : volume de matière divisé par volume de la maille.
densité du fer : masse matière contenue dans la maille ( 4 atomes en propre) divisée par le volume de la maille. rFe = 4 MFe / (Na3Fe) = 8165 kg m-3. d = 8,16. c
rsite = 27,8 pm. sites octaèdriques : positionnés au milieu des arètes de la maille et il en existe un au centre de la maille. Ils sont au nombre de : 12 / 4 +1 = 4. Au centre d'une arète ce site est tel que : rFe + rsite = 0,5 a avec 4 rFe=1,414 a rsite = 0,146 a = 0,414 rFe = 51,32 pm
|
|||||
|
|
|