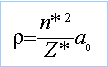|
|
|||||||||||||||||||
|
alcalins |
corrigé |
||||||||||||||||||
|
|
Na : 1s2 2s2 2p6 3s1 constante d'écran des électrons de coeur vis à vis de l'électrons 3s : s3s =8*0,85 + 2*1 = 8,8 charge nucléaire effective : Z*=11-8,8 =2,2 Energie de l'électron 3 s :
L'énergie de première ionisation est l'opposée de l'énergie orbitalaire de l'electron arraché : 7,31 eV
pour le potassium : K : 1s2 2s2 2p6 3s2 3p6 4s1 s4s =8*0,85 + 10*1 = 16,8 Z*=19-16,8 =2,2 et n*=3,7 d'où : 4,81 eV pour le rubidium : Rb : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 s5s =8*0,85 + 28*1 = 34,8 Z*=37-34,8 =2,2 et n*=4 d'où : 4,11 eV L'énergie de première ionisation diminue au sein d'une même famille quand n croît.
|
||||||||||||||||||
|
période du magnésium |
corrigé |
||||||||||||||||||
|
|
énergie orbitalaire des électrons 4s : s4s =0,35+8*0,85 + 10*1 = 17,15 Z*=20-17,15 =2,85 et n*=3,7 E4s= -13,6(2,85/3,7)²= -8,10 eV
Ca+ : 1s2 2s2 2p6 3s2 3p6 4s1 énergie orbitalaire de l'électron 4s restant : s4s =8*0,85 + 10*1 = 16,8 Z*=20-16,8 =3,2 et n*=3,7 E'4s= -13,6(3,2/3,7)²= -10,17 eV d'où l'énergie de première ionisation du calcium : -10,17-2(-8,10) = 6,03 eV Ca2+ : 1s2 2s2 2p6 3s2 3p6 pour Ca2+ il n'y a plus d'électron 4s; l'énergie orbitalaire de l'électron 4s est connue . D'où l'énergie de seconde ionisation du calcium : 10,17 eV. Pour une même valeur de n des électrons de valence, l'énergie de première ionisation augmente avec Z Al : 1s2 2s2 2p6 3s2 3p1 Al+ : 1s2 2s2 2p6 3s2 le fait d'arracher l'électron p donne une stabilité plus grande à l'ion Al+, (sous niveau 3s complet) donc une énergie de première ionisation inférieure à celle attendue. S: 1s2 2s2 2p6 3s2 3p4 Al+ : 1s2 2s2 2p6 3s2 3p3 le fait d'arracher l'électron p donne une stabilité plus grande à l'ion S+, (sous niveau 3p à moitié plein) donc une énergie de première ionisation inférieure à celle attendue.
|
||||||||||||||||||
|
l'atome d'argent |
corrigé |
||||||||||||||||||
|
|
en fait la configuration réelle est :1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 l'orbitale 4 d saturée stabilise l'atome. Ag+ : 1s2 2s2
2p6 3s2 3p6 4s2
3d10 4p6 4d10
s5s =0,35+17*0,85 + 28*1 = 42,80 Z*=47-42,8 = 4,2 et n* = 4 E5s= -13,6(4,2/4)²= -15 eV énergie orbitalaire de l'électrons 4d : s5s =0,35*8 + 36*1 = 38,8 Z*=47-38,8 = 8,2 et n* = 3,7 E5s= -13,6(8,2/3,7)²= -66,8 eV L'énergie des électrons 4d étant
plus basse, avoir le maximum d'électrons dans cette
orbitale stabilise l'atome.
s5s =18*0,85 + 28*1 = 43,3 Z*=47-43,3 = 3,7 et n* = 4 E5s= -13,6(3,7/4)²= -11,64 eV d'où l'énergie de première
ionisation 11,64 eV,
l'électron 5s étant le seul électron de
l'orbitale.
avec n*=4 et Z*=3,7 et a0=52,9 pm d'où r=228,7 pm |
||||||||||||||||||
|
|
|

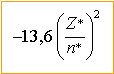 avec
n*=3 d'où
-7,3
eV.
avec
n*=3 d'où
-7,3
eV.