| |
élément fer dans un vin blanc ( France bac juin 97) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||
| |
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
colorimètrie absorbance casse ferrique |
Au cours de l'élaboration d'un vin blanc ou au cours de son stockage, un trouble peut apparaître. Ce trouble, appelé casse ferrique ou casse blanche, constitué d'un précipité de phosphate de fer (III), est peu attrayant et gênant sur le plan gustatif. Un vin représente un risque de casse lorsque sa teneur globale en élément fer (ions fer (II) et ions fer (III)) dépasse, selon le type de vin, 10 à 20 mg . L-1 . Pour déterminer cette teneur, on utilise ici un dosage spectrophotométrique. Principe du dosage spectrophotométrique. Un spectrophotomètre mesure l'absorbance d'une substance colorée. Une fois l'appareil réglé, si la substance étudiée est la seule substance colorée de la solution, l'absorbance est proportionnelle à sa concentration massique.
Préparation de l'échelle de teintes. On réalise des mélanges à partir d'une solution S contenant 8 mg d'ions fer (II) par litre. Les mélanges préparés sont présentés dans le tableau ci-dessous. Chaque mélange a une teinte différente. Dans tous les cas le volume total du mélange est de 40 cm3 .
Le dosage spectrophotométrique On mesure l'absorbance A des différentes solutions préparées. Les résultats sont reportés sur le graphe ci dessous où C représente la concentration massique en ions fer (II) dans les mélanges. 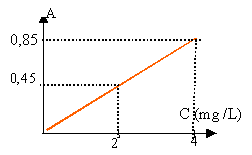 Pour effectuer le dosage du vin étudié, on prépare le mélange M suivant : 20.0 cm3 de vin blanc à tester ; 17.0 cm3 d'eau distillée ; 1.0 cm3 de solution d'hydroquinone à 0.2 % ; 2.0 cm3 de réactif o-phénanthroline. L'absorbance Avin de la solution préparée à partir du vin blanc est égale à 0,45.
|
|||||||||||||||||||||||||||||||||||||||||||||||
| |
A = constante de proportionnalité fois C réduction des ions fer III : Fe3+ + e- donne Fe2+. Les ion fer II et fer III sont présents dans le vin. Deux dosages sont nécessaire pour doser ces deux espèces. par contre si les ions Fe3+ sont réduits sous forme d'ions Fe2+, on dose en une seule fois l'élément fer, alors présent sous forme d'ion Fe2+. Les volumes de la solution S et d'eau distilée sont prélevés à la burette. Les volumes de solution d'hydroquinone et le réactif o-phénanthroline sont prélevés à la pipette. Les concentrations en ion Fe2+ diminue de la solution 1 à la solution 8. La solution 1 est la plus teintée, puis la couleur diminue régulièrement jusqu'à la solution 8. Dans S il y a 8 mg d'ion Fe2+ par litre Dans le mélange n°4 il y a 12,5*8 / 1000 = 0,1 mg d'ion Fe2+ dans 40 mL de mélange . soit 0,1/0,04 = 2,5 mg d'ion Fe2+ par litre. travail sur le graphique : trouver le coefficient directeur de la droite : 0,85 / 4 =0,21 A=0,21 C lorsque A=0,45 alors la concentration de l'élément fer dans le mélange est : C =0,45 / 0,21 = 2 mg / L soit 2*40/1000 = 0,08 mg d'élément fer présent dans les 20 mL de vin. Cvin = 0,08 / 0,02 = 4 mg /L Ce vin ne peut pas subir la casse ferrique, la valeur trouvée est inférieure à 10 mg / L.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|