| |
dosage des sucres Nlle Calédonie 12/97 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||
| |
|
||||||||||
|
|
jus d'ananas isomérie dosage redox |
Objectif : vérifier une des indications portées sur une étiquette de bouteille de jus d’ananas : dans de jus. m (glucides) =10 g dans 100 mL de jus. Parmi les glucides que contient la pulpe d’un fruit avant d’être mûr, le saccharose est fortement majoritaire ; l’hydrolyse de ce composé,noté S , en milieu acide, dans la pulpe, se produit suivant le schéma : S+ eau donne G + F avec G : glucose, F : fructose. Si bien que, suivant le degré de maturité et la provenance des fruits, les quantités de G, F, S varient. On admettra que seuls ces trois composés constituent les glucides présents dans le jus étudié, et que les quantités de matière de G et F sont égales. À froid, à l’obscurité et en milieu basique à pH=12,5, seule la fonction aldéhyde d’un ose est oxydée par le diiode. 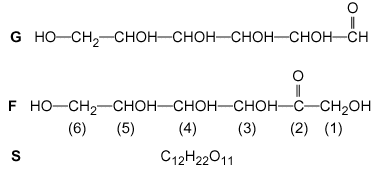
masse molaire (g/mol) : S=342 ; G=F=180. Étude des molécules de glucose et de fructose Le glucose G et le fructose F ont la même formule brute C6H12O6.
Étude expérimentale : Remarques :Le diiode est peu soluble dans l ’eau.On le dissout en présence d ’un excès d ’ions iodure .Par souci de simplication,on représentera le diiode en solution aqueuse par l ’entité I2. Première étape : dosage de la solution de diiode. La solution de diiode qui sera utilisée ultérieurement est dosée par une solution de thiosulfate de sodium de concentration 0,1 mol / L. L’équation-bilan correspondante est : I2 +2S2 O3 2– donne 2I – + S4O62-. .On réalise le dosage de 20 mL de la solution de diiode dans laquelle on ajoute de l’empois d’amidon. L’équivalence correspondant à la décoloration de la solution est obtenue pour un volume de la solution de 19,6 mL de thiosulfate de sodium. Calculer la concentration molaire C0 de la solution de diiode. Deuxième étape : dilution de la solution commerciale. On dilue, après l’avoir filtré, le jus d’ananas de la bouteille cinq fois : on obtient ainsi la solution A. On admettra que le résidu solide restant après filtration est de masse négligeable et ne contient pas de glucides. Troisième étape :détermination de la quantité de glucose initialement présent dans un échantillon de jus dilué. On recherche la quantité (exprimée en moles) de glucose
contenue dans de jus dilué A. Pour cela, on mélange 10 mL de solution
A, V0= 20 mL de solution de diiode et 7 mL de solution
tampon de pH=12,5. Dans ces conditions, le diiode est en excès et le
glucose (noté G) de la solution A est transformé en ion gluconate RCOO La transformation du glucose RCHO en ions gluconate se traduit par l’équation-bilan : Le mélange est placé à l’obscurité à température ambiante pendant une demi-heure, puis on acidifie le milieu afin de pouvoir doser le diiode excédentaire. Pour doser le diiode excédentaire à la fin de la troisième étape il a fallu verser V'1 =12,7 mL de la solution de thiosulfate de sodium de concentra-tion C1.
Quatrième étape :détermination de la quantité de saccharose contenue dans l’échantillon de jus dilué. On recherche la quantité de saccharose, noté (S) , contenue dans 10 mL de A. Pour cela, on réalise l’hydrolyse du saccharose en chauffant à reflux en milieu acide, 10 mL de la solution A pendant vingt minutes. La solution obtenue contient le « glucose total », c’est-à-dire celui initialement présent dans A et celui obtenu après hydrolyse de (S). Un mode opératoire analogue à celui de la troisième étape permet de déterminer la quantité de « glucose total ». On trouve que dans 10 mL de A, nG total = 5,88 10-4 mol.
|
|||||||||
| |
carbone asymétrique : carbone tétragonal lié à 4 groupes différents. les atomes de carbone n° 3, 4, 5 de la molécule F sont asymétriques dans la molécule G on trouve un alcool primaire en bout de
chaine, un aldehyde à l'autre extrémité et 4 groupes alcool secondaire
dans la partie centrale.
C0 = 0,049 mol
/L.
Qté de matière thiosulfate : 12,7*0,1 = 1,27 mmol en conséquence 1,27 /2 = 0,635 mmol I2 en excès Qté matière I2 initiale : 20C0 = 20*0,049 = 0,98 mmol Qté I2 ayant réagi : 0,98-0,635 = 0,345 mmol donc 0,345 mmol glucose dans 10 mL de A. L'hydrolyse d'une mole de saccharose donne une mole de glucose et une mole de fructose. donc 0,345 mmol fructose dans 10 mL
de A.
soit 0,558-0,345 = 0,213 mmol de glucose issu du saccharose en conséquence 0,231 mmol de saccharose dans 10 mL de A. dans A : [glucose]=[fructose]=0,345/10=0,0345 mol /L dans A [saccharose]=0,231/10=0,0231mol/L Dans le jus non dilué : [glucose]=[fructose]= 5*0,0345 = 0,1725 mol/L ou 0,01725 mol dans 100 mL [saccharose]= 5*0,0231 =0,1155 mol /l ou 0,01155 mol dans 100 mL soit en masse : 0,01725 *180 = 3,1 g fructose 3,1 g glucose 0,01155*342 =3,95 g saccharose total glucides : 10,015 g en accord avec l'étiquette.
|
||||||||||
|
|
|