sciences
physiques et industrielles
- Un circuit RC est alimenté par une tension provenant d'un générateur de signaux périodiques rectangulaires u(t)=u0(t) +uc, u0(t) étant sa composante alternative et uc sa valeur moyenne. On se place en régime permanent. La fréquence de u0(t) est 1 kHz et son amplitude E=6V. On choisit uc=0, R=3,3kW et C=33nF.
- Comment en pratique appelle t-on uc?
- Représenter la tension aux bornes de la résistance. Qui a t-il de changé si on règle uc à 3V.
- On désire compléter le montage afin que la tension de sortie w(t) ne soit plus composée que des impulsions correspondantes au front montant du signal u(t), les autres étant supprimées. Cette tension doit être disponible aux bornes d'une résistance R3= 0,33 MW. Dessiner le montage.
- On désire que chaque impulsion composant w(t) soit supérieure à 5 V pendant 60 ms. Quelle sera la nouvelle valeur de C' si R reste inchangée. Dessiner l'allure de la rension w(t) ainsi obtenue.
corrigé
constante de temps du dipôle RC : t = RC= 3,3 103 * 33 10-9 voisin 0,1 ms.
demi période du signal : 0,5 ms voisin de 5 t.
Durant une demi période du signal rectangulaire, le condensateur a le temps de se charger, puis de se décharger à la demi période suivante.
Aux bornes de la résistance on observe l'image de l'intensité.
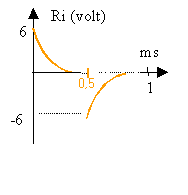
Si uc =3 volts , on n'observe pas de modification de cette courbe en revanche la courbe représentant la tension aux bornes du condensateur serait décalée vers le haut.
résistance équivalente à R et R3 en dérivation peu différente de R car R3 est égale à 100 fois R
w(t) = 6 exp (- t / (RC))
à t = 6 10-5 s, w(t) = 5 V soit ln (5/6) = - 6 10-5 / (3,3 103 C)
C' voisin 15 nF.
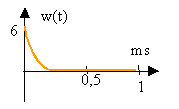
- Un automobiliste roulant sur autoroute horizontale à la vitesse de 126 km/h aperçoit un obstacle. Il freine à partir d'une date t=0 et le mouvement est uniformèment ralenti. A partir de l'instant t=0, la voiture parcourt 125 m et le choc est évité. Quelle est la durée du freinage?
- Le conducteur a un poids de 800N. Qulle est la composante horizontale des forces qui lui sont appliquées pendant la durée du freinage.
- Un second conducteur suit le premier à une distance de 70 m. Il roule à la même vitesse. Il commence freiné à la date t = t0 positive. Sa voiture a un mouvement ralenti identique à celui de la première voiture (arrêt sur 125m) calculer la valeur maxi de t0 permettant d'éviter le choc entre les voitures.
corrigé
durée du freinage :
v²f - v²0 = 2a d d'où valeur de a = -35² / 250 = - 4,9 m/s²
v = -4,9 t+35
doù t = 35/4,9 = 7,14 s
force appliquée au conducteur, dirigée vers l'avant :
norme de ces forces :4,9*masse (kg) = 4,9*800/9,8 = 400 N
premier véhicule : d1 = -½ *4,9 t²+35t
à l'arrêt : d1=125 m et t =7,14 s
second véhicule :
mouvement rectiligne uniforme pendant t0 s, puis mouvement uniformément ralenti
d2 = 35t0-½*4,9 (t-t0)²+35(t-t0)-70
cas limite d1 = d2 = 125 m
125 = 35t0 -2,45 (7,14-t0)²+35(7,14-t0)-70
-2,45 t0² +35 t0 -70 =0
résoudre l'équation du second degré : t0 =2,4 s .
- Une éprouvette graduée est renversée sur la cuve à eau. Elle contient du dihydrogène produit par la réaction complète de 6,5 cg de magnésium sur de l'acide chlorhydrique en excès. La température ambiante est 23°C , la pression 1018 hPa et l'équilibre thermique est réalisé. Le volume du gaz dans l'éprouvette est 66,5 mL. Montrer en admettant que H2 est un gaz parfait que l'on peut en déduire la valeur f de la pression de vapeur saturante de l'eau à 23°C. Mg=24,31 g/mol; R=8,314 J mol-1K-1.
- Exprimer f en mm de mercure sachant que sous la pression de 1013 hPa la pression atmosphérique est égale à 760 mm Hg.
- Que vaut la pression de vapeur saturante de l'eau à 100°C.
corrigé
Quantité de matière de magnésium :
0,065 /24,31 = 2,674 mmol
donc 2,674 mmol H2.
volume molaire : V= RT / P
T=273+23 = 296 K et P= 1,018 105 Pa
V= 8,314*296 / 1,018 105 =24,17 L
volume H2 : 2,674*24,17 = 64,63 mL
volume vapeur d'eau : 1,87 mL
fraction molaire de la vapeur d'eau : 1,87 / 66,5 = 0,028
pression de vapeur saturante : 0,028*1018 = 28,6 hPa.
28,6*760/1013 = 21,4 mm Hg
la pression de vapeur saturante de l'eau à 100°C est égale à la pression atmosphérique : 1013 hPa
On introduit dans un ballon 50 mL d'essence et 50 mL d'acide chlorhydrique concentré. On adapte au ballon un réfrigérant (montage à reflux) et un piège à chlorure d'hydrogène. Le mélange est porté à ébullition pendant 30 min. Le plomb contenu dans cette essence se trouve alors sous forme de chlorure de plomb.
- Dessiner le montage à reflux comportant le piège à chlorure d'hydrogène. Donner le nom des différents éléments.
- Après refroidissement le contenu du ballon qui comporte une phase organique (densité 0,7)et une phase aqueuse est versé dans une ampoule à décanter. Le chlorure de plomb se trouve dans la phase aqueuse.Dessiner l'ampoule à décanter avec les deux phases.
- Le chlorure de plomb est séparé de la
phase aqueuse puis purifié par recristallisation.
Le solide obtenu est dissout dans 100 mL d'eau
distilée (le plomb est à l'état
d'ion Pb2+). On prélève 10 mL de
cette solution. les ions Pb2+ sont
dosés par complexométrie en milieu
tamponé pH=4,7 par une solution d'EDTA à
0,001 mol/L. L'indicateur de fin de réaction vire
au jaune pour un volume d'EDTA ajouté égal
à 9,7 mL.
Avec quel instrument prèlève t-on 10 mL.
Donner le schéma légendé du dosage.
Pourquoi l'indicateur de fin de réaction change t-il de couleur à la fin du dosage.
Que signifie EDTA. - Sachant que la réaction de dosage entre Pb2+ et l'EDTA est équimolaire, déterminer la concentration des ions Pb2+ dans la prise de 10 mL
- Sachant que Pb=207 g/mol déterminer la masse de plomb dans 1 L d'essence.
corrigé
Au dessus du réfrigérant adapté un tuyau plongeant dans une solution de soude pour fixé le chlorure d'hydrogène qui se dégage.
ampoule à déquanter : la phase la plus dense (ici l'eau) occupe la partie inférieure et la phase la moins dense (ici la partie organique) occupe la partie supérieure.
prélevé 10 mL à la pipette jaugée surmontée d'un pipeteur.
burette graduée contenant la solution d'EDTA
erlenmeyer( placé sur agitateur magnétique ) contenant la solution aqueuse (ion Pb2+) et quelques gouttes d'indicateur de fin de réaction.
l'indicateur change de couleur en réagissant avec l'EDTA, dès que la solution ne contient plus d'ion plomb.
EDTA: éthylène diammine tétracétique.
Quantité de matière d'ion Pb2+ dans 10 mL: 9,7 10-6 mol
[Pb2+ ] = 9,7 10-6/ 0,01 =9,7 10-4 mol/L
masse de plomb dans 1 L d'essence :207*9,7 10-4 = 0,2 g
Un triglycéride est un triester du glycérol et d'un acide gras( acide carboxylique comptant un nombre pair d'atomes de carbone). On étudie un corps gras contenant de la palmitine et de l'oléïne qui sont des triglycérides respectivement de l'acide palmitique et de l'acide oléïque. L'acide palmitique est saturé et contient 16 carbones; l'acide oléïque compte 18 carbone et une double liaison carbone carbone entre les carbones n°9 et 10.
- Donner les formules semi-développées de ces deux acides et calculer leurs masses molaires (C=12, H=1; O=16 g/mol)
- Donner les formules semi développées du glycérol, de la palmitine et de l'oléïne.
- On souhaite d'éterminer l'indice de saponification Is d'un corps gras, c'est à dire la masse de potasse, exprimée en mg, nécessaire pour saponifier les esters contenus dans 1g de corps gras. Ecrire l'équation bilan de la saponification d'un triglycéride par la potasse.
- On réalise une solution alcoolique de potasse (0,7 g de potasse dissout dans de l'alcool éthylique à 95%) afin d'obtenir 1 L de solution. Dix mL de cette solution sont dosés par une solution d'acide chlorhydrique à1,02 10-2 mol / L. Le volume d'acide à l'équivalence est 11,8 mL. Calculer la concentration de la solution de potasse (K=39 g/mol)
- Dans un ballon on introduit 60 mL de la solution
alcoolique de potasse précédente et 0,2 g
de matière grasse. On chauffe à reflux
pendant 1 heure. On considère que la
réaction de saponification est terminée.
Après refroidissement on ajoute dans le ballon 3
gouttes de phénolphtaléïne et
lentement de l'acide chlorhydrique à 1,02
10-2 mol/L pour doser la potasse en
excès. L'équivalence est atteinte pour un
volume égal à 8,15 mL.
Pourquoi utilise t-on une solution alcoolique de potasse et non une solution aqueuse.
Ecrire l'équation bilan de la réaction acido basique et calculer la quantité de matière de potasse en excès.
En déduire la masse de potasse utilisée pour saponfier 0,2 g de matière grasse.
Calculer son indice de saponification.
Déterminer le nombre de mole de triester contenu dans 1 g de matière grasse.
corrigé
acide oléïque : CH3-(CH2)6-CH=CH-(CH2)8-COOH ; M= 282 g/mol
glycérol : HO-CH2-CHOH-CH2OH
palmitine : (RO- est le groupe CH3-(CH2)14-COO-)
RO-CH2-CHOR-CH2OR
oléïne : (RO- est le groupe CH3-(CH2)6-CH=CH-(CH2)8-COO -)
RO-CH2-CHOR-CH2OR
R-CO2-CH2-CH[O2C-R]-CH2-O2C-R + 3(K+; HO-) donne glycérol + 3 R-CO2- + 3K+.
dosage acide base:
à l'équivalence CaVa=CbVb
Cb= 1,02 10-2*11,8 / 10 = 1,20 10-2 mol /L
la matière grasse est plus soluble dans la solution alcoolique que dans la solution aqueuse.
la potasse est soluble dans l'eau et dans la solution alcoolique.
les 2 réactifs sont présents dans la même phase et vont mieux réagir.
saponification :
Qté de matière de KOH initial : 1,2 10-2*60 = 0,72 mmol
H3O++ HO- donne 2 H2O
Qté de matière de potasse en excès : 8,15* 1,02 10-2 = 0,083 mmol
donc 0,637 mmol de potasse a réagi
masse de potasse : 0,637 *(39+16+1) = 35,67 mg pour 0,2 g de matière grasse
ou bien 178,3 mg de potasse par gramme de matière grasse.
0,637 mmol de potasse a réagi avec 0,637/ 3 = 0,212 mmol de matière grasse contenu dans 0,2 g.
soit 1,06 mmol dans 1g