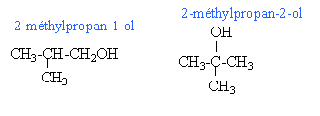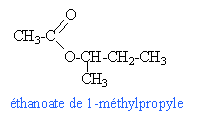|
chimie
|
|
|
acide base mélange de solutions |
On donne : HNO2/ NO2- pKa=3,3 HCOOH / HCOO- pKa=3,8
corrigé |
|
solution de méthanoate de sodium : présence de la base ion méthanoate. A égale concentration, une base est d'autant plus forte que le pKa du couple correspondant est plus grand. Donc la base ion méthanoate est une base faible plus forte (pH le plus élevé) que l'ion nitrite. A égale concentration, un acide est d'autant plus fort que le pKa du couple correspondant est plus petit. Donc l'acide nitreux est l'acide faible le plus fort (pH de la solution le moins élevé). 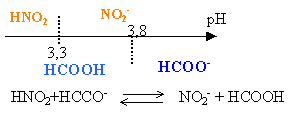
l'acide nitreux et l'ion méthanoate ont des domaines de prédominance disjoints : en conséquence, ils réagissent naturellement et la constante de réaction est supérieure à 1. faire la différence positive des 2 pKa : on trouve 0,5 Kr = 10 0,5 =3,16 réaction partielle, limitée.
l'ion nitrite et l'acide méthanoïque ont des domaines de prédominance communs : en conséquence, ils ne réagissent pas naturellement et la constante de réaction est inférieure à 1. faire la différence négative des 2 pKa : on trouve -0,5 Kr = 10 -0,5 =0,316 valeur inverse de la valeur précédente réaction partielle, encore plus limitée.
|
|
|
chimie organique |
corrigé |
|
A l'équivalence du dosage acide base: CaVa=CbVb 12,5 *2 = 25 mmol de soude soit 25 mmol d'acide 0,025 = masse acide (g) divisé par la masse molaire de l'acide M = 1,5 / 0,025 = 60 g /mol. il s'agit de l'acide éthanoïque CH3-COOH. le composé C est un alcool CH3-CH2-CH2-CH2OH butan-1-ol. CH3-CH2-CHOH-CH3 butan-2-ol.
seul le butan-2-ol possède un carbone asymétrique et en conséquence 2 énantiomères.
|