Au contact de l'air une plaque d'aluminium se recouvre spontanément d'une couche d'oxyde d'aluminium Al2O3 qui la protège d'une oxydation ultérieure. Afin de renforcer cette protection, on provoque la croissance de la couche d'alumine par électrolyse. Pour réaliser cette protection on immerge la plaque d'aluminium de surface totale S=1 dm² et une électrode inattaquable dans une solution d'acide sulfurique, puis on relie les 2 électrodes à un générateur qui fait circuler un courant constant d'intensit é I=1A pendant 10 minutes.
données Al =27 g/mol ;O=16 g/mol ; 1F=96500C ; masse volumique de l'alumine 3,13 g/cm3.
Quelle(s) est (sont) l'(es) affirmation(s) exacte(s) ?
- la demi réaction électronique
Al2O3 / Al est :
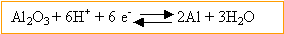
- la plaque d'aluminium est la cathode.
- dans l'électrolyte, les électrons se dirigent vers la plaque d'aluminium.
- l'épaisseur d'oxyde d'aluminium déposé est de 3,4 10-4 cm.
- au cours de l'électrolyse , il y a transformation d'énergie électrique en énergie chimique.
corrigé
oxydation de l'aluminium en alumine : une oxydation est réalisée à l'anode positive de la cuve à électrolyse.
Dans une électrolyse l'énergie électrique reçue est convertie en énergie chimique et en énergie thermique (effet Joule)
Les électrons se déplacent dans les métaux; les ions assurent le passage du courant en solution.
x : (en cm) épaisseur du dépôt d'alumine
volume d'alumine (cm3) = surface (cm²) fois épaisseur (cm) = 100 x cm3.
masse alumine (g) = masse volumique ( g/cm3) fois volume (cm3) = 3,13 *100x = 313 x grammes
quantité de matière (mol) d'alumine : masse (g) / masse molaire (g/ mol) = 313 x / 102 = 3,07 x mol
quantité de matière d'électrons(mol) : 6*3,07 x = 18,41 x mol.
6 mol d'électrons par mol d'alumine (voir coefficients d' l'équation ci-dessus)
La charge d'une mol d'électrons est : 96500 C
Quantité de matière d'électricité (C): 96500* 18,47 x = 1,77 106 x C
intensité (A) fois durée (s) = 1*10*60 = 600 C
x = 600 / 1,77 106 = 3,4 10-4 cm.