Sur la paillasse d’un laboratoire se trouvent les produits suivants:
sodium ; bleu de bromothymol ; aniline ; liqueur de Fehling ; arséniate de sodium ; chlorure de potassium ; butan-2-ol ; formaldéhyde (ou méthanal) ; mercure ; propan-1-ol ; cyclohexane ; éthanoate de butyle ; propanone ; indigo.
On dispose de 4 armoires : produits minéraux ; produits organiques ; poisons ; indicateurs colorés, colorants, réactifs.
- Comment rangez-vous ces produits ?
- Préciser les familles (ou fonctions) des produits organiques.
- Quelles sont les précautions à prendre quand on conserve le sodium et quand on le manipule ? Comment élimine-t-on les résidus de sodium après utilisation ?
corrigé
produits minéraux : sodium ; chlorure de potassium
produits organiques : butan-2-ol, (alcool secondaire)
propan-1-ol (alcool primaire) cyclohexane
éthanoate de butyle (ester) propanone (cétone)
poisons : mercure, aniline,(amine), arséniate de sodium, formaldéhyde (ou méthanal)(aldehyde)
indicateurs colorés, colorants, réactifs :bleu de bromothymol, liqueur de Fehling, indigo.
Le sodium ne doit pas être mis en contact avec l'eau. Il doit ètre conservé dans l'huile.
Sur un flacon de un litre d’une solution commerciale d'ammoniaque, on lit :
densité d = 0,92 ; pourcentage en masse d'ammoniac : 20 %.
- Quelle est la formule de l'ammoniac ? Quelle est sa masse molaire moléculaire ?
- Calculer la concentration molaire c0 de la solution commerciale.
- On veut préparer un litre de solution d'ammoniac de concentration c = 0, 10 mol.L-1. Quel volume Vo de solution commerciale faut-il prélever ? ( justifier )
- Indiquer les différentes étapes de la préparation, en précisant le matériel à utiliser, et le mode opératoire.
Masse volumique de l’eau : 1 000 g.L -1
corrigé
920 *0,2 =184 g d'ammoniac pur par litre
184 / 17 = 10,8 mol L-1.
volume pipette(mL)* concentration de la solution mère = volume fiole jaugée (mL) * concentration finale
volume pipette = 1000*0,1 /10,8 = 9,26 mL
prélever 9,2 mL à la pipette + pipeteur
placer dans fiole jaugée de 1000 mL
compléter avec de l'eau distillée.
On se propose d’étudier l’oxydation des ions iodure par l’eau oxygénée. Les potentiels redox standard des couples ont pour valeurs :E° ( H2O2 / H2O ) = 1,77 V ; E° ( I2 / I - ) = 0,62 V
On utilise une solution commerciale d’eau oxygénée à 20 volumes.
- Donner le nom scientifique de l’eau oxygénée. Quelles sont ses utilisations dans la vie courante ? Pourquoi doit-on conserver l’eau oxygénée dans des flacons teintés ?
- "eau oxygénée à 20 volumes" signifie qu’un litre de cette eau oxygénée peut libérer 20 litres de dioxygène dans les conditions normales de température et de pression. On doit préparer 1 litre de solution d’eau oxygénée de concentration 0,1 mol.L-1 à partir de la solution commerciale d’eau oxygénée à 20 volumes dans les conditions normales de température et de pression. On rappelle que l’équation-bilan de la réaction de décomposition de l’eau oxygénée s’écrit : H2O2 donne H2O + 1/2 O2 (g).Quel est le volume de solution commerciale à prélever ?Quelle verrerie utiliseriez-vous pour effectuer le prélèvement et pour préparer la solution ?
- On mélange dans un becher à la date t = 0 : 10 mL d’iodure de potassium à 0,1 mol.L-1 ; 10 mL d’acide sulfurique à 1 mol.L-1 ; 2 mL d’eau oxygénée à 0,05 mol.L-1 ; 3 mL d’eau distillée. Calculer à la date t = 0 la concentration des ions iodure, notée [ I - ]0, du mélange réactionnel.
- Ecrire les demi-équations électroniques des couples oxydant-réducteur en présence. En déduire l’équation-bilan de la réaction.
- On veut suivre la cinétique de cette réaction à l’aide d’un montage informatisé. On dispose des éléments suivants : 1- interface ; 2- imprimante ; 3-spectrophotomètre ; 4- micro-ordinateur. En représentant chaque élément par un carré numéroté, faire un schéma du montage. Préciser dans quel ordre vous allumez les appareils et dans quel ordre vous les arrêtez.
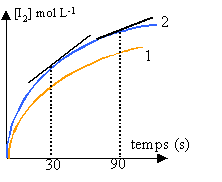
- On enregistre à l’ordinateur la courbe donnant la concentration du diiode formé en fonction du temps. On obtient la courbe n° 2. Le logiciel permet de tracer deux tangentes en deux points différents et de calculer les pentes (ou coefficient directeur) et les ordonnées à l’origine. Pente à t=30s =5 10-3 mol L-1 s-1. Pente à t=90s =2 10-3 mol L-1 s-1. A l’aide des informations données et sans faire de calcul, donner les valeurs de la vitesse de formation du diiode à la date t1 = 30 s et t2 = 90 s. Comment varie-t-elle au cours du temps?
- Pour étudier l’influence de la température sur la vitesse de la réaction, on enregistre à l’ordinateur les courbes obtenues lors de deux expériences identiques mais faites à des températures différentes : l’une à 25° C = q A ; l’autre à 35° C = q B. Sans faire de calcul, préciser à quelle courbe n° 1 ou n° 2 correspondent q A et q B et justifier votre choix.
corrigé
la lumière accentue la réaction de décomposition en dioxygéne et eau.
concentration de la solution à 20 volumes :
20/22,4 =0,893 mol O2 libéré soit [H2O2]=2*0,893 = 1,786 mol L-1
volume pipette(mL)* concentration de la solution mère = volume fiole jaugée (mL) * concentration finale
volume pipette = 1000*0,1 /1,786 = 56 mL
prélever 56 mL à la pipette + pipeteur
placer dans fiole jaugée de 1000 mL
compléter avec de l'eau distillée.
10*0,1 = 1 mmol ion iodure ou 10-3 mol dans 25 mL
[I-]0 = 0,04 molL-1.
2I- + 2e- donne I2
H2O2 +2H+ +2e- donne 2H2O
2I- +H2O2 +2H+donne I2 +2H2O.
imprimante et interface reliés au micro-ordinateur
spectrophotomètre relié à l'interface.
allumer dans l'ordre : spectrophotomètre, interface, imprimante, ordinateur
éteindre dans l'ordre inverse.
La vitesse de formation du diiode est égale à la pente de la tangente à la courbe à la date donnée.
Cette vitesse diminue lorsque les concentrations des réactifs diminuent.
La température est un facteur cinétique : la vitesse d'une réaction augmente si la température augmente .
La courbe 2 correspond à la température la plus élevée.
- On se propose d'étudier à charge Rc
fixe l'influence de la tension d'entrée sur la
stabilisation de la tension de sortie Us et le rendement
d'un R.I.T 7805 régulateur 5V. On réalise
le montage ci-contre :
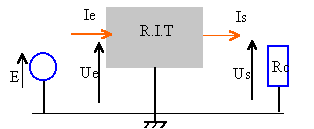
- Représenter à nouveau ci-dessous le montage avec les appareils de mesures permettant de mesurer Ie, Ue, Is et Us.
- Lorsque la tension E varie de 3 V à 10 V, on
relève les mesures suivantes :
Calculer la valeur de Rc.Ue (V) 3 4 5 6 7 8 10 Ie (A) 0,14 0,22 0,31 0,4 0,49 0,49 0,49 Us (V) 1,4 2,2 3,1 4 4,9 4,9 4,9 Is (A) 0,14 0,22 0,31 0,4 0,49 0,49 0,49 Pe (W) Ps (W) h - On note : Pe, la puissance d’entrée et Pu, la puissance utile. Compléter le tableau en calculant : Pe = Ue.Ie ; Pu = Us.Is et h = Pu / Pe .
- Tracer ci-dessous les courbes Us = f(Ue) et h =f(Ue). (échelles : 1 cm pour 1 V et 1 cm pour 0,10).
- A l'aide de ces deux courbes, préciser la valeur de Ue pour laquelle on a à la fois stabilisation de Us et un bon rendement.
- Que se passe-t-il si la tension d'entrée est supérieure à cette valeur ?
- Que se passe-t-il si la tension d'entrée est inférieure à cette valeur ?
- En déduire la fonction qui peut être réalisée par un R.I.T.
corrigé
résistance Rc = Us / Is = 10 ohms
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
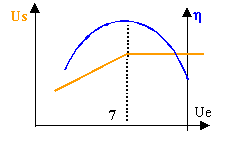
si Ue est supérieure à 7 V, la tension de sortie est stabilisée à 4,9 V, mais le rendement n'est pas optimal.
si Ue est inférieure à 7 V, il n'y a pas stabilisation de la tension de sortie et le rendement n'est pas optimum.
RI.T : stabilise la tension de sortie.
- Attribuer à chaque dispositif le bon vocabulaire : biconcave, ménisque divergent, biconvexe, plan convexe, plan concave, ménisque convergent, lentilles à bords minces, lentilles à bords épais, divergentes, convergentes.
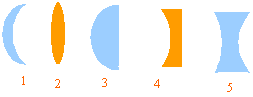
- Construire l'image A'B' d'une flèche lumineuse
AB perpendiculaire à l'axe principal située
entre le foyer principal objet et le centre optique d'une
lentille convergente. Peut-on observer l'image sur un
écran ? Si on place son oeil au voisinage du foyer
image F', quel objet usuel a-t-on réalisé ?
Pourquoi ?
corrigé
lentille à bords minces biconvexe (2) convergente
plan convexe (3) convergente
plan concave (4) divergente
ménisque convergent (1)
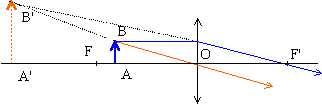
Cette lentille convergente fonctionne en loupe : l'image virtuelle ne peut pas être observée sur un écran.
- Un mobile auto-porteur est lâché, à t = 0, sans vitesse initiale, sur une table plane, inclinée d'un angle a par rapport au plan horizontal. Ce mobile laisse des traces sur une feuille, par étincelage, à intervalles de temps égaux à D t = 40 ms. Expliquer le principe de fonctionnement d'un mobile auto-porteur, du dispositif de marquage à étincelles.
- On peut ainsi mesurer sur la feuille la distance d parcourue par le mobile depuis sa position initiale, en fonction du temps t (les valeurs de d ont été mesurées à 0,5 mm près). Ces données d et t sont entrées manuellement dans l’ordinateur et traitées par le logiciel qui calcule la vitesse instantanée V. On obtient sur l'écran de l'ordinateur le tableau suivant :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Le logiciel permet d'obtenir l'équation de cette représentation graphique et d’afficher sur l'écran de l'ordinateur :
V = a.t ; a = 3,37 + ou - 0,03
Dans le menu "TRAITEMENT" du logiciel, choisir parmi les options suivantes (constantes, dérivée, intégration, modélisation) celle qui permet d’obtenir cette équation.
Quelle est l'unité de la constante a ? Quelle grandeur physique cette constante représente -t-elle ?
4. L'étude théorique du mouvement du mobile montre que V = g.sina .t .
Que représente la constante g? Quelle est sa valeur à Paris?
Quelles sont les valeurs possibles de l'angle a , en tenant compte de l'incertitude sur la valeur de a ?
corrigé
Entre le mobile auto-porteur et la table on réalise un coussin d'air, ce qui supprime les frottements.
Un dispositif réalise une étincelle à intervalle de temps égaux, entre la pointe de l'auto-porteur et la feuille carbonée conductrice, d'où l'inscription des différentes positions du solide auto-porteur.
D'après le tableau de mesure vitesse et temps sont proportionnelles.. La vitesse est une fonction linéaire du temps.
Le coefficient de proportionnalité représente l'accélération (m s-2).
Le menu modélisation permet de trouver l'équation de cette droite.
g=9,8 ms-2 , accélération de la pesanteur, gravitation au niveau du sol terrestre.
3,34 < g sin a < 3,40
3,41 < sin a < 0,348
19,93 < a < 20,36