|
transformations
lentes ou rapides
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
L'ammoniac de format NH3
, est l'une des espèces chimiques les plus importantes
industriellement. Il sert en effet à préparer des nettoyants ménagers,
des engrais, des explosifs, des fibres textiles (par exemple, le nylon)
…. Sa synthèse se fait en phase gazeuse à partir de diazote et de
dihydrogène, à une température de 450 °C environ.
- Ecrire l'équation de la réaction.
- Pourquoi opère t on à une température élevée ?
- On peut étudier en laboratoire cette réaction en fermant un
mélange de diazote et de dihydrogène dans un récipient muni d'un
manomètre.Qu'est ce qu'un manomètre ? Comment évolue la pression du
mélange au fur et à mesure que la réaction se produit, la température
du réacteur restant constante ?
- Si l'on part d'un mélange de 25 moles de diazote et 75
moles de dihydrogène, quelle quantité de matière d'ammoniac peut on
théoriquement obtenir ?
- Expérimentalement, on n'en obtient que 22 moles. Calculer le
rendement de la réaction.
corrigé
3H2 + N2 = 2NH3.
la température est un facteur cinétique : la vitesse de la
réaction augmente.
Le manomètre permet la mesure de la pression du mélange gazeux.
volume du réacteur et température constantes, comment évolue
le nombre de moles ?
|
3H2
|
+ N2
|
= 2NH3
|
|
initial
|
75
|
25
|
0
|
|
en cours
|
75-3x
|
25-x
|
2x
|
|
final
|
0
|
0
|
50 mol
|
à la date t : 75-3x + 25-x+2x = 100-2x mol
or PV = nRT, si la quantité de matière en moles diminue alors
la pression diminue.
rendement 22 / 50 = 44%.
|
| .
. |
|
On souhaite préparer une solution
aqueuse d'hydroxyde de sodium, de concentration cb=0,10
mol/L, à partir d'une solution S1, de concentration c1
environ égale à 1,1 mol/L. On dilue S1, pour obtenir une
solution S2 de volume V2=500 mL, dix fois moins
concentrée que S1.
- Préciser le matériel nécessaire pour effectuer cette
dilution dans les meilleures conditions de sécurité, en indiquant la
suite logique des opérations à effectuer.
- Quelle est alors la concentration c2 de la solution S2
?
- Pour vérifier la valeur de c2, on prélève un
volume Vb=10,0 cm3 de la solution S2,
que l'on titre par une solution aqueuse d'acide chlorhydrique, de
concentration ca=0,100 mol/L, en présence de bleu de
bromothymol. Le virage de l'indicateur coloré à lieu pour un volume
équivalent Véquiv=12,5 cm3 de la solution d'acide
versé.
- Faire un schéma du dispositif utilisé au cours du titrage, en nommant
les instructions de verrerie.
- Ecrire l'équation chimique de la réaction du titrage.
- Déduire de la mesure de Véquiv la valeur de la
concentration c2 de la solution S2.
- A partir de la solution S2, on prépare un volume
V=250 cm3 de solution S d'hydroxyde de sodium, de
concentration cb=0,10 mol/L, dans une fiole jaugée de
contenance 250 mL. Quel volume v'b de S2 doit on
utiliser ?
corrigé
facteur de dilution = 10 ; volume de la
fiole jaugée = 500 mL, donc :
prélever 50 mL de la solution mère à l'aide d'une pipette de
50 mL + pipeteur
placer dans la fiole jaugée et compléter avec de l'eau
distillée jusqu'au trait de jauge.
porter des lunettes de protection
c2 = 0,11 mol/L.
acide chlorhydrique de concentration connue dans
la burette
10 mL solution S2 à doser dans le bécher ou dans un
erlenmeyer + indicateur coloré
agitateur magnétique
H3O+ + HO- --> 2H2O
à l'équivalence du dosage d'un monoacide par une monobase : Ca
Véqui = CbVb
soit Cb = 0,1*12,5 / 10 = 0,125
mol/L.
facteur de dilution = 0,125/0,1=1,25 ; volume de
la fiole jaugée = 250 mL, donc :
prélever 250/1,25 = 200 mL de la solution S2 à
l'aide d'une pipette ou d'une burette graduée
placer dans la fiole jaugée et compléter avec de l'eau
distillée jusqu'au trait de jauge.
|
|
Le zinc réagit avec l'acide
chlorhydrique : les produits de la réaction sont les ions Zn2+
et du dihydrogène.
- Ecrire l'équation chimique de la réaction.
- Quel couples oxydant / réducteur fait elle intervenir ?
- On plonge un petit morceau de zinc dans l'acide
chlorhydrique et on étudie la cinétique de la réaction en mesurant, à
l'aide d'une éprouvette graduée, le volume de dihydrogène produit au
cours du temps, on obtient les résultats suivants :
|
t (min)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
V H2(mL)
|
0
|
6,3
|
9,9
|
12
|
13,5
|
14,5
|
- Justifier que la technique de mesure utilisée est bien adaptée au
suivi cinétique de la réaction.
- Tracer le graphe représentant la quantité de matière de dihydrogène
formée en fonction du temps, sachant que le volume molaire dans les
conditions de l'expérience est de 24 L/mol.
- Si on faisait la même expérience avec l'acide moins concentré,
faudrait il plus ou moins de deux minutes pour recueillir 9,9 mL de
dihydrogène ?
- Le volume de gaz produit au bout d'un temps très long sera-t-il le
même pour les deux expériences.
- On utilise deux systèmes initiaux de compositions
identiques, à la même température, avec dans un cas du zinc en poudre
et dans l'autre cas du zinc en grenaille.
- On observe que le dégagement gazeux est plus important dans le
système où le zinc est à l'état de poudre. Sachant que la réaction a
lieu à la surface du métal, proposer une interprétation.
- Le volume gazeux obtenu à l'état final est il le même dans les deux
cas ? Pourquoi ?
corrigé
couples redox Zn/Zn2+ et H+/H2.
Zn + 2H+-->Zn2+ +H2.
|
t (min)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
V H2(mL)
|
0
|
6,3
|
9,9
|
12
|
13,5
|
14,5
|
|
n H2(mmoL)= V/24
|
0
|
0,262
|
0,412
|
0,5
|
0,562
|
0,604
|
la réaction étant relativement lente il est possible de mesurer le
volume du gaz sur une cuve à eau : H2 insoluble dans l'eau.
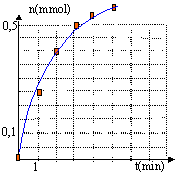
la concentration des réactifs est un facteur cinétique : la
vitesse de la réaction augmente avec leur concentration.
si l'acide est moins concentré il faudra plus de deux minutes
pour recueillir 9,9 mL de gaz.
Si le zinc est le réactif limitant, alors le volume de gaz
obtenu sera le même
si l'acide moins concentré est le réactif limitant, le volume
de gaz sera plus faible.
la réaction chimique se fait à la surface du métal : plus
celle-ci est grande ( solide en poudre) , plus la vitesse de la
réaction est importante. L'état final sera plus rapidement atteint.
Par contre l'état final sera identique, si les quantités
initiales de réactifs sont les mêmes.
|
|
On étudie la transformation lente de réduction des ions
peroxodisulfate S2O82- (aq) par les
ions iodure I- (aq). Ces deux réactifs appartiennent aux
couples oxydant / réducteur S2O82-
(aq) / SO42- (aq) et I2(aq)/ I-(aq)
- Ecrire l'équation chimique de la réaction.
- On mélange 10 mL d'une solution aqueuse de peroxodisulfate
de sodium [S2O82- ] = 1,0 10-2
mol/L et 10 mL d'une solution aqueuse d'iodure de calcium, on
concentration molaire en ions iodure [ I-] = 0,01 mol/L.
Effectuer un bilan de matière à l'état final.
- On renouvelle l'expérience avec 10 mL d'une solution
aqueuse dont la soluté est du peroxodisulfate de sodium, Na2S2O8
(s) de concentration massique cm=2,38g/L, et 10 mL d'une
solution aqueuse dont le soluté est de l'iodure de calcium, Cal2
(s), de concentration massique c'm = 2,94 g/L. La
température du système est la même que précédemment.
- Effectuer un bilan de matière à l'état final.
- Pour quelle valeur de l'avancement ce système se trouve t il dans le
même état que l'état final du système précédemment étudié ?
- Lequel des deux systèmes atteint cet état le plus rapidement ?
- Sachant que le diiode est une espèce colorée en solution
aqueuse, proposer une méthode de suivi temporel de la transformation.
Masses molaires atomiques M(Na)=23g/mol M(S)=32,1 g/mol
M(O)=16g/mol M(Ca)=40 ,1 g/mol M(I)=126,9 g/mol
corrigé
S2O82-
+ 2I--->2SO42- + I2
|
S2O82-
|
+ 2I-
|
2SO42-
|
I2
|
|
initial
|
10-4 mol
|
10-4 mol
|
0
|
0
|
|
en cours
|
10-4 -x
|
10-4 -2x
|
2x
|
x
|
|
fin
|
5 10-5 mol
|
0
|
10-4 mol
|
5 10-5 mol
|
dans le cas des solides : concentration massique (g/L) /
masse molaire (g/mol) * volume (L)= Qté de matière (mol)
Ca I2(s) --> Ca2+ + 2I-.
donc nI- = 2 *2,94/294*0,01 =
|
S2O82-
|
+ 2I-
|
2SO42-
|
I2
|
|
initial
|
10-4 mol
|
2 10-4 mol
|
0
|
0
|
|
en cours
|
10-4 -x
|
2 10-4 -2x
|
2x
|
x
|
|
fin
|
0
|
0
|
2 10-4 mol
|
10-4 mol
|
ce second système atteint l'état final du premier système (
exception faite de l'ion iodure)
lorsque l'avancement vaut x= 5 10-5 mol.
la vitesse de la réaction est plus grande si la concentration
des réactifs est plus importante: le second système atteint cet état le
plus rapidement.
le suivi de l'évolution de la réaction peut être effectué par
spectrophotométrie : suivi de l'évolution de la couleur brune du diiode.
|
|
|
