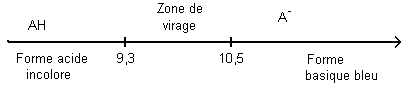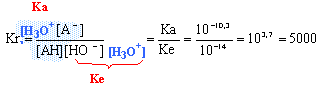|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
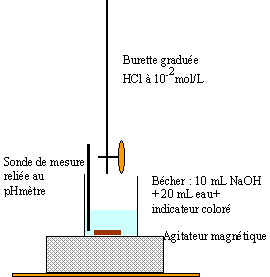
Le dioxyde de carbone est présent dans l'air atmosphérique à raison de 0,63% en volume. Il peut réagir avec les ions hydroxyde ; l'équation- bilan de cette réaction est : CO2 + 2HO- --> CO32- + H2O Préparation et dosages d'une solution aqueuse d'hydroxyde de sodium ou soude : On rappelle que la soude (ou hydroxyde de sodium) a pour formule NaOH. Pour en préparer une solution aqueuse de concentration connue, on ne dispose que d'un flacon de pastilles de soude, la masse d'une pastille étant approximativement égale à 0,1g. On commence donc par préparer une solution de concentration voisine de 0,01mol/L ; pour connaître précisément la concentration de la solution préparée, on réalise ensuite un dosage. Liste du matériel et des solutions disponibles au laboratoire : - agitateur magnétique et barreau aimanté ; - fioles jaugées portant les mentions "50 mL", "100 mL", "200 mL", "1 L" ; - pipettes jaugées portant les mentions "1 mL", "5 mL", "10 mL", "20 mL" ; " - burettes graduées portant les mentions "20 mL", "25 mL", "50 mL" ; - pipettes graduées portant les mentions "1 mL", "5 mL", "10 mL" ; - éprouvettes graduées portant les mentions "10 mL", "50 mL", "100 mL ; - erlenmeyers et bechers portant les mentions "50 mL", "100 mL", "200 mL" ; - poire aspirante ou propipette â ; - solutions d'acide chlorhydrique à 1 mol/L, 0,10 mol/L, 0,010 mol/L ; - indicateur coloré : phénolphtaléine. Données : masses molaires atomiques : M(H) = 1 g/mol ; M(O) = 16 g/mol ; M(Na) = 23 g/mol
Farces et attrapes : la tache qui disparaît... Dans les magasins de farces et attrapes est proposée une solution bleue, appelée "encre anti-tache". Lorsque l'on verse un peu de cette solution sur un vêtement, une tache bleue apparaît, mais.... disparaît en quelques minutes. Voilà comment fabriquer la solution "encre anti-tache" : - Produits et solutions nécessaires avec quelques indications Solution de soude à 1 mol/L : corrosive. Thymolphtaléine : indicateur coloré de zone de virage : 9.3 - 10.5 ; Constante d'acidité du coulpe associé : Ka = 10-10,3. soluble dans l'eau et l'éthanol. - Mode opératoire Ajouter quelques gouttes de solution de thymolphtaléine dans un mélange d'eau et d'alcool, la solution est alors incolore. Ajouter ensuite goutte à goutte juste assez de soude de manière à obtenir une solution bleue : "l'encre anti-tache". On admet que la solution se comporte comme une solution aqueuse.
Attention : la solution "encre anti-tache" contenant de la soude concentrée, on évitera de l'utiliser sur des vêtements non usagés.
masse molaire de la soude : 23+16+1 = 40 g/mol masse à peser à la balance de précision : 0,01*40 = 0,4 g. Il faut utiliser une fiole jaugée de 1L et y introduire 4 pastilles de soude ; ajouter un peu d'eau distillée, agiter pour dissoudre les pastilles, puis compléter la fiole jusqu'au trait de jauge (à la goutte près) afin que le bas du ménisque affleure le trait de jauge. Agiter pour homogénéiser la solution. Pour ne préparer que 100mL de cette solution, il faudrait prendre une masse 10 fois moindre puisque 100mL représente un dixième de litre. Or, compte tenu du fait qu'il n'y a pas de balance au laboratoire, cela semble difficile de prendre le dixième de 4 pastilles. La solution préparée est une solution de monobase forte. Il faut donc la doser avec une solution de monoacide fort de même concentration, donc une solution d'acide chlorhydrique à 0,010 mol/L puisque l'équation de la réaction est : H3O+ + HO- --> 2 H2O
Lors du premier dosage, à l'équivalence : n(HO-) dosé = n(H3O+) verséé = 0,01 V Lors du 2ème dosage, toujours à l'équivalence, mais 3 jours après : n(HO-) dosé + n(CO32-) dosé = n(H3O+) verséé = 0,01 V' d'après l'équation :CO2 + 2HO- --> CO32- + H2O 1 mole d'ions carbonate, CO32- apparue implique la disparition de 2 moles d'ions HO- donc cV' < cV
le pH est inférieur à 9,3 puisque la solution incolore, comme la forme acide de la thymolphtaléine prédominante. AH + HO- --> A- + H2O
Kr est grand la réaction est quantative ; elle peut être considérée comme quasi-totale. la teinte de la forme basique est bleue puisqu'en ajoutant de la solution de soude, on obtient de "l'encre anti-tache". L'autre facteur qui pourrait également intervenir est la carbonatation de la soude (réaction des ions hydroxyde de la soude avec le dioxyde de carbone de l'air). |
|||||
|