|
cinétique de réaction bac centres étrangers I- 06 / 01 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Pendant une séance de travaux pratiques, des élèves sont chargés d'étudier la vitesse de la réaction de décomposition de l'eau oxygénée ou peroxyde d'hydrogène.Cette réaction s'effectue en présence d'un catalyseur, solution contenant des ions fer III Fe3+. La réaction catalysée:
influence de la quantité de catalyseur : On confie à différents groupes d'élèves l'objectif suivant : Effectuer la réaction avec différentes quantités de catalyseur, afin de déterminer la quantité convenable pour que la décomposition de l'eau oxygénée, tout en demeurant lente, soit pratiquement terminée en une heure. On constitue quatre groupes A, B, C, D: pour chacun la concentration c d'eau oxygénée (solution mère) est la même. La solution catalytique est également la même. Le procédé est le suivant : - prélever 10 mL d'eau oxygénée et les introduire dans un bécher qu'on appellera le réacteur. - ajout d'un volume V1 d'eau. - à la date t=0, ajouter un volume V2 de catalyseur et déclencher simultanément le chronomètre.
étude cinétique : A différentes dates imposées les élèves prélèvent à la pipette 10 mL du mélange réactionnel qu'ils placent dans un erlenmeyer contenant 50 mL d'eau distillée glacée. Un dosage par une solution S de permanganate de potassium acidifiée permet de déterminer la quantité d'eau oxygénée restante. A l'équivalence le volume de la solution S versée est notée V3.
Concentration initiale :
Choix de la quantité de catalyseur :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
un catalyseur augmente la vitesse d'une réaction ; il n'apparaît pas dans le bilan un catalyseur peut orienter une réaction
lorsque deux issues sont possible.
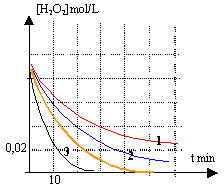
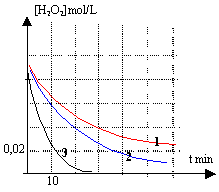
La vitesse de réaction dépend de la concentration du catalyseur. Dans le réacteur D l'eau oxygénée se décompose plus rapidement que dans le réacteur A.
la courbe (2) correspond au groupe B : il reste à t=60 min 1* 0,005 = 0,005 mol/L de'au oxygénée. la courbe (3) correspond au groupe D :
ne reste plus d'eau oxygénée à t=60 min.
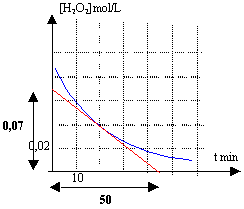
vitesse de disparition de l'eau oxygénée à t= 20 min : 0,07 / 50 = 1,4 10-3 mol L-1 min-1. refroidir dans l'eau glacée diminue fortement la vitesse d'une réaction. La trempe a pour effet de bloquer la réaction de décomposition de l'eau oxygénée: ce qui permet le dosage de l'eau oxygénée restant.
le volume de la solution dans le réacteur est de 100 mL pour les quatre groupes 10 mL de solution mère + V1 mL eau + V2 mL solution catalyseur facteur de dilution : volume du réacteur / volume solution mère = 10 la concentration de la solution mère est : 10*0,09 = 0,9 mol/L.
la courbe C est la plus adaptée. le volume de solution catalytique est voisin de 3 mL.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|