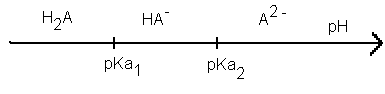|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
Les principaux constituants connus de la pomme sont en pourcentage massique de la totalité (pulpe, pelure, pépins) : eau (84 % à 93 %), sucres réducteurs (8.3 %), saccharose (1.6 % à 4 %), cellulose, pentacosane, acides, protides, matières grasses, cendres. Les acides sont presque essentiellement l'acide malique avec des traces d'acides acétiques, d'acide formique, d'acide caproïque, d'acide panthoténique, l'acide gallotannique, d'acide ascorbique (vitamine C). Cet exercice a pour but d'étudier l'acidité d'un jus de pomme, considérée comme due uniquement à l'acide malique, dont la formule semi-développée et quelques données sont répertoriées ci-après : acide malique Données : HOOC-CHOH-CH2-COOH Masse molaire de l'acide malique : 134 g/mol Valeurs des pKa des couples acide-base associés à l'acide malique : pKa1 = 3,4 et pKa2 = 5,1. Molécule d'acide malique
Propriétés acido-basiques L'acide malique est un diacide que l'on notera de façon simplifiée H2A.
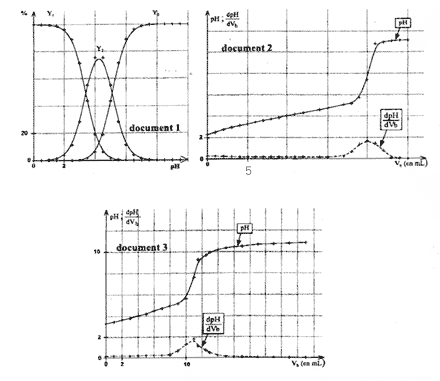 - Existe-t-il un domaine de pH pour lequel ces conditions sont réalisées ? Conclure. - On ajoute progressivement à 10 mL d'une solution aqueuse d'acide malique, une solution aqueuse d'une monobase forte. La variation du pH de la solution d'acide malique et celle de la dérivée en fonction du volume de la solution de monobase forte ajoutée sont données dans le document 2 ci-dessus. L'allure de la courbe de pH est-elle en accord avec la conclusion de la question précédente ? Justifier. - Les concentrations molaires des deux solutions d'acide malique et de monobase forte utilisées pour étudier ces variations sont toutes deux égales à 0,10 mol/L. Montrer que l'équation-bilan ci-dessous est en accord avec le volume de monobase forte versé à l'équivalence. H2A + 2HO- --> A2- + 2H2O Dosage de l'acide malique dans un jus de pomme On prélève un volume V=10 mL de jus de pomme pur et on le dose par une solution aqueuse d'hydroxyde de sodium ou soude de concentration molaire. Les courbes du document 3 ci-dessus, représentent la variation du pH du jus de pomme et celle de la dérivée en fonction du volume de solution de soude ajoutée.
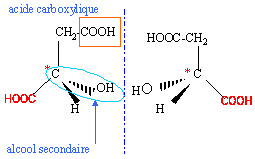
Le carbone n° 2 est un carbone asymétrique : il est lié à 4 groupes d'atomes différents. La molécule est donc chirale ; ses deux énantiomères sont représentés ci-dessus. Propriétés acido-basiques H2A + H2O= H3O+ + HA- HA- + H2O = H3O+ + A2- . La forme HA- est une forme amphotère : elle est à la fois la base conjuguée de l'acide H2A et l'acide conjugué de la base A2-.
Non, il n'existe pas de domaine de pH pour lequel ces conditions sont réalisées. A la première équivalence, le pourcentage molaire de H2A est de l'ordre de 15%. Donc, on ne peut doser les deux acidités de l'acide malique successivement. Oui, tout à fait, on n'observe sur la courbe , qu'un seul saut de pH. H2A + 2HO- --> A2- + 2H2O A l'équivalence : 2 n( acide) = n (HO- versé) or Ca = Cb d'où 2 Va = VbE (1) D'après la courbe dérivée dpH/ dV = f(V) , l'abscisse de son extremum correspond au volume équivalent. Par lecture graphique, Vbe = 20mL. Comme Va = 10 mL,
la relation (1) est vérifiée.
D'après la relation établie précédemment 2CV= CbVbe, pour le jus de pomme : C =Cb Vbe/ (2V) = 0,1*11 / (2*10) = 0,055 mol/L. L'acide malique a pour formule brute : C4H6O5 Par rapport à l'acide lactique, , il y a une différence d'un atome de carbone et de deux atomes d'oxygène donc la réaction chimique a pour équation : C4H6O5 --> C3H6O3 + CO2 |
|||||
|