|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||
|
|||||||||||||||||
|
|
Un réchaud électrique a une puissance calorifique de 400W. Il chauffe 0,5L d'eau, dont la température passe de 20°C à 80°C. Quelle est la durée du chauffage? masse volumique de l'eau: 103 kg/m3 ; capacité thermique massique de l'eau 4190 J kg-1 K-1. La capacité calorifique du récipient est négligeable ainsi que les échanges de chaleur avec l'air.
corrigé |
||||||||||||||||
|
masse (kg) * capacité thermique de l'eau (J kg-1 K-1 )* différence de température (°C) 0,5 L d'eau a une masse de 0,5 kg. 0,5 *4190*60 = 125 700 J. puissance (W) = énergie (J) / durée (s) durée = 125700 / 400 = 314 s. |
|||||||||||||||||
|
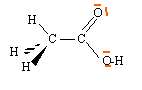
L'acide acétique de masse molaire 60 g/mol, est le constituant essentiel du vinaigre.
corrigé formule brute d'un acide carboxylique ( une seule fonction acide) : CxHyO2. avec x, y nombres entiers masse molaire : 12x + y + 32 = 60 g/mol d'où 12 x + y = 28 (1) pourcentage massique de carbone : 12 x / 40 = 60 /100 =0,6 soit x = 2. pourcentage massique d'hydrogène : y / 6,7 = 0,6 d'où y= 4. CH3 -CO2H acide éthanoique
|
|||||||||||||||||
|
On charge un accumulateur de fcem E'= 5,2V et de résistance interne r'= 4,7 ohms sous une tension constante pendant 10 heures. L'intensité du courant est de 83 mA.
corrigé augmentation de l'énergie chimique lors de la charge : E'I t avec I = 0,083 A et t = 10*3600 = 36 000 secondes 5,2 *0,083 * 36 000 = 15538 joules. énergie perdue sous forme de chaleur : r' I² t 4,7 *0,083² *36 000 = 1166 J. le générateur en charge se comporte en récepteur énergie totale reçue = énergie transformée en énergie chimique + énergie transformée en chaleur tension aux bornes du générateur en charge : E'+ r' I = 5,2 + 4,7*0,083 = 5,59 volts.
|
|||||||||||||||||
|
Une luge et son passager de masse totale m = 70 kg descend sans vitesse initiale ( VA = 0m/s) une piste inclinée de 15 % . Après avoir parcouru 100 m de distance elle atteint un point B avec une vitesse VB = 30 km/h
corrigé différence d'altitude h=15 m pour 100 m parcouru travail moteur du poids en descente : mgh = 70*9,8*15 = 10290 J. travail des frottements W variation énergie cinétique : 30 /3,6 = 8,33 m/s D Ec = 0,5 mv²-0 = 0,5*70*8,33² =2430 J th de l'énergie cinétique : 2430 = W + 10290 d'où W = -7860 J. f = 7860 / 100 = 78,6 N. en absence de frottements : 0,5 mv² = 10290 v = rac. carrée ( 2*10290 / 70) =17,1 m/s. variation énergie potentielle = opposée du travail du poids pas de variation de l'énergie mécanique en absence de frottements.
|
|||||||||||||||||
|
On dispose d' une poudre blanche dont la seule propriété connue est d'être un acide carboxylique de formule brute CxHyO2. On se propose de mener une enquête pour identifier ce composé organique . - 250mL d'une solution S est préparée en pesant 0,40g du composé organique. - on remplit une burette de 25mL de soude (hydroxyde de sodium) de concentration Cb = 0,01 mol/L. - dans un bêcher de 200mL, on place un volume de 10mL de solution S ,on rajoute 20mL d'eau distillée.
masse atomique molaire C=12 ; O=16 ; H=1 g/mol corrigé couples acide base : RCOOH / RCOO- et H2O / HO-. RCOOH + HO- donne RCOO- + H2O on note C la concentration de la solution S en acide RCOOH et V le volume de soude ajouté
à l'équivalence acide base quantité de matière de soude ajouté est égale quantité de matière d'acide 13,1*0,01 = 0,17 mmol soude qté de matière d'acide n = 0,131 = 10 C avec C concentration de l'acide C = 0,0131 mol/L soit 0,0131*0,25 = 0,003275 mol dans 250 mL de solution ou dans 0,40 g de ce composé masse molaire de ce composé : 0,4/ 0,003275 =122 g/mol donc C6H5-COOH acide benzoïque.
|
|||||||||||||||||
|