|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||
|
||||||||||||
|
|
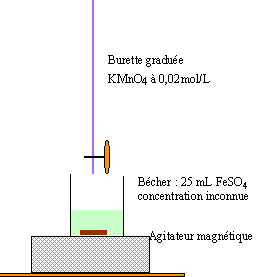
Donnée : M (FeSO4, 7 H2O ) = 278,0 g.mol-1. En milieu fortement acidifié, l'ion permanganate intervient à partir de la demi-équation électronique suivante : MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O
|
|||||||||||
|
l'ion manganèse II, Mn2+ est la forme réduite; il est incolore. 5 Fe2+ = 5 Fe3+ + 5 e- oxydation du réducteur MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O réduction de l'oxydant dans le bilan les électrons n'apparaissent pas : MnO4- + 8H+
+5 Fe2+ donne Mn2+ +5
Fe3+ + 4 H2O
oxydo-réduction
avant l'équivalence l'ion permanganate est en défaut dans le bécher ; l'ion Fe2+ est en excès. la solution dans le bécher reste incolore. A l'équivalence les quantités des réactifs mis en présence sont dans les proportions stoéchiomètriques. après l'équivalence, les ions Fe2+ sont en défaut, les ions permanganates ajoutés sont en excès. la solution dans le bécher prend une teinte violette. tableau d'évolution :
V (L) : volume de la solution titrée ( à 0,02 mol/L) de permanganate de potassium ajouté à la burette. à l'équivalence : 0,025 C - 5*0,02Ve = 0 C = 5*0,02 *0,0215 / 0,025 = 0,086
mol/L.
préparation de ½ L soit 0,086 / 2 = 0,043 mol masse molaire du solide : 278 g/mol masse (g) = 278*0,043 = 11,95 g. peser le solide à l'aide d'une balance électronique de précision dissoudre dans un peu d'eau distillée utiliser une fiole jaugée de 500 mL et compléter jusqu'au trait de jauge avec de l'eau distillée.
|
||||||||||||
|