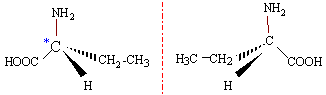|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
|
Je détermine la formule brute de A : formule brute CxHyOz avec x, y, z entiers 12x / 54,6 = 0,88 d'où x = 4 y / 9,1 = 0,88 d'où y = 8 16 z / 36,3 = 0,88 d'où z =2. A est soluble dans l'eau. Sa solution fait virer le bleu de bromothymol au jaune. La chaîne carbonée de A est linéaire. il s'agit d'un acide carboxylique ( le BBT devient jaune) à chaine linéaire comptant 4 atomes de carbone. CH3-CH2-CH2-CO2H acide butanoïque.
CH3-CH2OH +
CH3-CH2-CH2-CO2H
équilibre avec
CH3-CH2-CH2-CO2-CH2-CH3
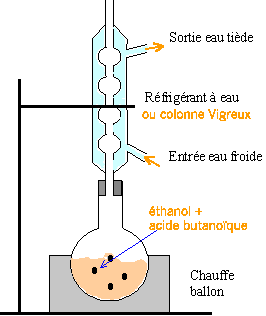
+H2O Le chauffage à reflux permet d'accélérer la réaction en travaillant à température moyenne en évitant les pertes de matière.
On considère la formule B :
CH3-CH2-CH(NH2)-COOH. Le carbone porteur du groupe amino NH2 est asymétrique : il possède 4 substituants différents. la molécule est chirale, non superposable à son image dans un miroir. elle possède deux isomères optiques ou énantiomères.
La molécule A, sans carbone asymétrique ne possède pas cette particularité. |
||
|
|
||
|
|