|
Synthèse magnésienne :
triphénylméthanol En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
Formes de Kékulé du
benzène
Règle permettant de savoir si un composé organique cyclique possède les mêmes propriétés que le benzène : Un polyène monocyclique et plan constitue un système aromatique lorsque le nombre d'électrons p est égal à 4n+2, n étant entier. Quelles précautions faut-il prendre pour manipuler le benzène et pourquoi ? liquide inflammable et toxique ( cancèrogène pour l'homme) Port de blouse, gants, lunette de potection, travail sous hotte aspirante, en absence de toute flamme. Nature des réactions subies facilement par le benzène : substitution électrophile d'un hydrogène du benzène Equation de la réaction permettant l'obtention du bromobenzène, composé A, à partir du benzène : C6H6 + Br2 = C6H5Br + HBr (catalyseur AlBr3 anhydre). Pour obtenir à partir de
l'acide benzoïque le benzoate d'éthyle
C6H5-COO-C2H5,
composé B, on réalise une
estérification en présence d'alcool
éthylique CH3-CH2-OH. On
utilise un dispositif de chauffage à reflux, le
catalyseur étant les ions oxonium. En remplaçant l'acide benzoïque par l'anhydride benzoïque la réaction est, par contre totale.
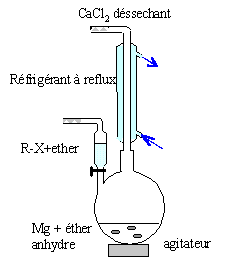
Le magnésium est utilisé en chimie organique pour fabriquer des réactifs de Grignard. On se propose de préparer le bromure de phénylmagnésium, composé C. Les réactifs à utiliser sont le bromobenzène, le magnésium, le solvant est l'éther éthylique anhydre. colonne Vigeux ou réfrigérant
droit surmonté d'un dispositif
déshydratant contenant CaCl2. ampoule de coulée ; ajout goutte à
goutte du dérivé bromé ballon bicol contenant de l'éther anhydre
et les copeaux de magnésium Dispositif d'agitation Réactions indésirable : réaction de couplage de Wurtz RBr + RMgBr = R-R + MgBr2. On l'évite en ajoutant
goutte à goutte le dérivé bromé
et en utilisant le magnésium en excès.
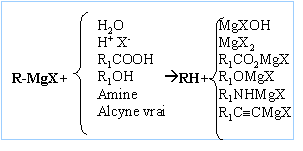
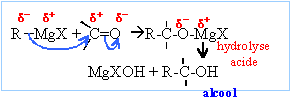
La réaction se termine par une hydrolyse en milieu acide. Le composé D obtenu après hydrolyse est un alcool tertiaire : F3C-OH, triphénylméthanol On hydrolyse en milieu acide : Les magnésiens étant
des bases fortes, l'hydrolyse forme Mg(OH)2 (s),
solide blanc. On évite la formation de l'hydroxyde de
magésium en hydrolysant en milieu acide ( solution de
NH4Cl ou acide sulfurique dilué).
On achève la synthèse en séchant la phase organique en utilisant un déshydratantt : MgSO4 anhydre, Na2SO4 anhydre. Principe de l'évaporateur rotatif : distillation rapide d'un solvant Distillation sous vide partiel. On
chauffe modérément la solution puis on fait
décroître progressivement la pression
jusqu'à ce que le solvant distille.
Plaque métallique chauffée par un dispositif électrique ; d'une extrémité à l'autre de la plaque s'établit un gradient de température. On étalonne cette plaque avec un ou deux échantillons dont on connaît parfaitement la température de fusion. On dépose quelques cristaux
du produit ( dont on désire connaître la
température de fusion ) sur la partie la plus froide
de la plaque, puis on déplace ces cristaux vers la
parite chaude, jusqu' à fusion de ces derniers.
Mis en présence d'acide sulfurique concentré le composé D donne une solution rouge : on déshydrate l'alcool tertiaire et le carbocation triphénylméthyle F3C+, stabilisé par résonnance, se forme. Un système conjugué de grandes dimensions absorbe la lumière dans le domaine visible : effet bathochrome ou déplacement du maximum d'absorbance vers les grande longueurs d'onde. D'où la couleur rouge observée, complémentaire de la couleur absorbée.
|
|||||||
|
|




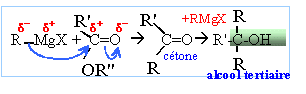 avec
R=R' = C6H5 noté
F.
avec
R=R' = C6H5 noté
F.