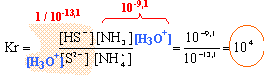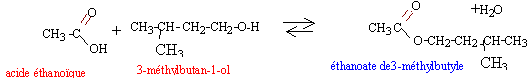|
( concours kiné Rennes 02) |
||||||||||||||||||||
|
||||||||||||||||||||
la constante est supérieure à 104 : la réaction est donc totale. (NH4+)2S (solide) donne 2 NH4+ + S2-
|
||||||||||||||||||||
|
texte : " Lorsqu'on parle de composition chimique du vin, il faut bien savoir que le vin ne peut pas être considéré comme une simple solution hydroalcoolique ( il ne contient en moyenne que 10% d'alcool). Le vin est le résultat de la transformation biologique d'un produit biologique le raisin. Cette transformation a lieu principalement sous l'action d'un micro-organisme la levure, qui se trouve sur la pellicule du raisin à maturité et dont la fonction principale est de métaboliser les sucres du raisin en éthanol, glycérol, acides carboxyliques et un ensemble complexe d'autres composés… Nos connaissances sur les constituants du vin ont augmenté de manière exponentielle ces dernières années grâce à l'apparition des techniques modernes comme la chromatographie. ces techniques ont permis l'identification et le dosage de près de 600 composés parmi lesquels on compte près de 200 esters, près de 140 acides carboxyliques, une cinquantaines d'alcools, des composés carbonylés, environ 30 composés azotés, des phénols, des composés soufrés…etc. La fermentation alcoolique prend la première place dans la production des composés volatils qui constituent le bouquet. Parmi les composés les plus abondant, il y a l'alcool isoamylique, 2-phényléthanol, isobutanol (ou 2-methylpropan-1-ol), propanol, butan-1-ol, 3-méthylthiopropanol. Les levures produisent également de nombreux esters comme l'éthanoate d'éthyle, l'éthanoate d'isoamyle, l'octanoate d'éthyle, l'hexanoate d'éthyle, le butanoate d'éthyle… leur teneur augmentant au cours du vieillissement… Parmi les autres composés volatils produits par les levures, on trouve l'acétaldehyde et quelques acides gras…. "
masse atomique molaire (g/mol) H=1 ; N=O=16 ; C=12
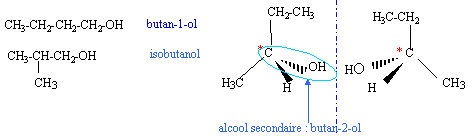
des molécules sont isomères lorsqu'elles ont la même formule brute mais des formules développées différentes.
isobutanol et butan-1-ol : même fonction alcool primaire mais des squelettes carbonés différents : isomèrie de chaine butan-1-ol et butan-2-ol : même chaine carbonée mais les positions de la fonction alcool sont différentes: alcool primaire et alcool secondaire.
Qté de matière des réactifs : acide éthanoïque (M=60g/mol) : 3,6 /60 = 0,06 mol alcool (M= 88 g/mol) : 2,2 / 88 = 0,025 mol ( réactif limitant) on peut espérer obtenir au maximum 0,025 mol d'ester dans le cas d'une réaction totale. ester (M= 130g/mol) : 1,82 /130 = 0,014 mol rendement : Qté expérimentale / Qté théorique = 0,014 / 0,025 = 0,56 (56%)
retour - menu |