|
service
de santé des armées
concours 2002
|
||||||||||||||||
|
||||||||||||||||
|
masses atomiques molaires g /mol : H=1 ; C=12 ; O=16. On souhaite préparer un ester par une réaction entre l'acide éthanoïque et le pentan-1-ol .
corrigé |
||||||||||||||||
|
nom de l'ester : éthanoate de propyle. l'estérification est lente, athermique, limitée par l'hydrolyse de l'ester. la température est un facteur cinétique : à température moyenne la vitesse de la réaction augmente. Le chauffage à reflux évite les pertes de matière. chauffe ballon, ballon réfrigérant droit en position verticale l'acide sulfurique est un catalyseur ; la pierre ponce régularise l'ébullition. Qté de matière initiale d'alcool : n1 = V1r1/ Malcool ; Qté de matière initiale d'acide éthanoïque : n2 = V2r2/ Macide ; mélange initial stoéchiométrique : n1= n2. V1r1/ Malcool = V2r2/ Macide ; V2 =V1r1Macide / (r2Malcool ) = 22 * 0,81 *60 / (1,05*88)= 11,6 mL. la réaction entre l'acide sulfurique concentrée et l'eau est exothermique : d'où l'eau glacée retour - menuner l'ampoule à décanter bouchée; agiter; puis ouvrir le robinet afin d'évacuer les éventuels gaz formés. Dans l'ampoule à décanter les liquides non miscibles se séparent par différence de densité : le liquide le plus dense occupe la partie inférieure partie inférieure : eau + acide restant partie supérieure : ester + alcool restant. rendement = masse réelle de l'ester*100 / masse théorique (réaction supposée totale) Qté de matière initiale d'alcool : 22*0,81 / 88 = 0,2025 mol Qté maximale d'ester : 0,2025 mol soit 0,2025*130 = 26,3 g. rendement 17 *100 / 26,3 = 64,6%. 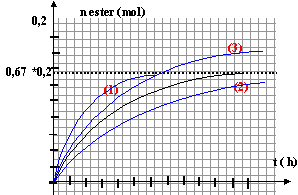
en remplaçant l'acide éthanoïque par l'anhydride éthanoïque (CH3CO)2O ou par le chlorure d'éthanoyle (CH3COCl) la réaction est totale, exothermique, rapide. CH3-COCl + CH3-(CH2)3-CH2OH --> CH3-COO-(CH2)4-CH3 + HCl (CH3CO)2O + CH3-(CH2)3-CH2OH --> CH3-COO-(CH2)4-CH3 + CH3COOH
retour - menu |