|
service de santé des armées concours 2002
|
||||||||||||||||
|
La vitamine C ou acide ascorbique est vendue en pharmacie sous forme de comprimés. On cherche à retrouver dans l'exercice les valeurs de la masse m de vitamine C dans un comprimé et du pKa du couple acide / base correspondant. Données à 25°C : masse molaire de l'acide ascorbique : 176 g/mol ; pKa = 4 masse d'acide ascorbique dans un comprimé : 500 mg d'après le fabricant concentration de la soude utilisée : Cb= 0,02 mol/L
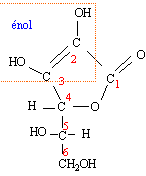 Les groupes encadrés correspondent à des fonctions énols.
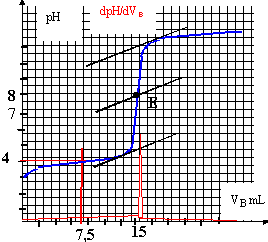
II Manipulation : Le comprimé écrasé est dissout dans un peu d'eau dans un bécher. Le contenu du bécher est transvasé dans une fiole jaugée de volume V=100 mL. On complète avec de l'eau distillée jusqu'au trait de jauge, la solution obtenue est notée S. On prélève un volume Va = 10 mL de la solution S, on le verse dans un bécher et on ajoute 20 mL d'eau distillée. Le dosage pH-métrique par une solution d'hydroxyde de sodium donne les résultats représentés par le document ci-dessous. 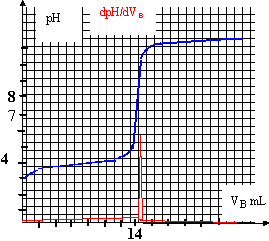 Questions : L'acide ascorbique est représenté par la formule simplifiée AH.
corrigé |
||||||||||||||||
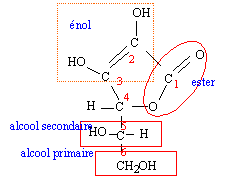
Un atome de carbone asymétrique est un atome de carbone tétraèdrique relié à 4 atomes ou groupes d'atomes différents. les atomes de carbone n°4 et n°5 sont asymétriques AH + HO- donne A- + H2O Kr =[A-] / ([AH][HO-]) =[A-] [H3O+] / ([AH][HO-][H3O+] )= 10-4 / 10-14 = 1010. cette constante étant très grande, la réaction est totale. A l'équivalence, les quantités de matière des réactifs mis en présence sont dans les proportions stoéchiométriques ; avant l'équivalence l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. coordonnées du point d'équivalence : E(Vb équi = 15 mL ; pH=8) on utilise la méthode des tangentes ; on remarque que la courbe dérivée passe par un maximum à l'équivalence.
l'espèce majoritaire à l'équivalence est l'ion A-, base conjuguée de l'acide AH ; la présence de la base faible A- majoritaire, est responsable de la valeur pH =8 (milieu basique ) Ca Va = Cb Vb --> Ca = 0,02*15 / 10 = 0,03 mol L-1. soit 0,003 mol dans 100 mL, c'est à dire dans un comprimé. masse d'acide ascorbique dans un comprimé : 0,003*176 =0,528 g ou 528 mg. écart relatif : 28 /500 =0,056 ( 5,6%); cet écart est faible. On ajoute de l'eau afin d'immerger correctement la sonde du pH-mètre ; l'eau n'apportant pratiquement pas d'ion oxonium, le volume de soude ajouté à l'équivalence ne sera pas modifié. à la demi équivalence du dosage acide faible base forte, le pH est égal au pKa du couple acide base faible. lecture graphique : ½ Vb équi =7,5 mL et pH voisin de 4 soit Ka voisin de 10-4. Le changement de couleur de l'indicateur coloré permet de repèrer l'équivalence. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( soit pH=8 dans ce cas) : on choisit donc le rouge de crésol.
retour - menu |