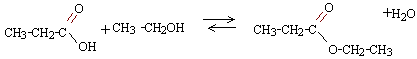|
kiné
Rouen
2001
|
|||
corrigé |
|||
|
équation de la combustion : CnH2nO2 + (1,5 n-1) O2 donne n CO2 + n H2O identifier A et B : Qté de matière de dioxyde de carbone (masse molaire CO2 = 44 g/mol) = 220 / 44 = 5 mol d'après l'équation bilan on obtient : 5 mol de vapeur d'eau Qté de matière de vapeur d'eau dégagée par la combustion d'une mole d'ester : 120 / 24 = 5 mol par conséquent lester compte n = 5 atomes de carbone. l'alcool A compte un atome de moins que l'acide B donc A est un alcool comptant 2 atomes de carbone dans le squelette carboné : éthanol. B est un acide carboxylique comptant 3 atomes de carbone : CH3-CH2-COOH acide propanoïque. l'ester est le propanoate d'éthyle.
préparation acide propanoïque : préparer l'acide propanoïque par oxydation du propan-1-ol en utilisant un oxydant ( dichromate de potassium ou permanganate de potassium ) en milieu acide sulfurique. 3 fois { CH3-CH2-CH2OH + H2O = CH3-CH2-COOH + 4H+ + 4 e-} oxydation. 2 fois { Cr2O72- + 14 H+ + 6 e- = 2Cr3+ + 7 H2O } réduction. 3 CH3-CH2-CH2OH + 2 Cr2O72- +16 H+ =3CH3-CH2-COOH + 4Cr3+ + 11 H2O oxydo-réduction.
retour - menu |