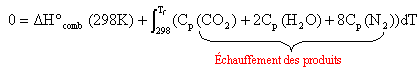|
exercice 1 : température finale d'un système |
||
|
||
|
On fait réagir H2 et O2 en proportions stoéchiométriques.
données : Df H° (H2Ogaz) = -241,83 kJ / mol à 298 K Cp°(J K-1 mol-1) H2 : 27,28 + 3,26 10-3 T O2 : 29,96 + 4,18 10-3 T H2O gaz : 30,01 + 10,71 10-3 T corrigé la réaction de formation de l'eau s'écrit : H2 (g) + ½O2(g) --> H2O(g) ; Df H° (H2Ogaz) = -241,83 kJ / mol à 298 K réaction totale et rapide signifie : le dégagement de chaleur échauffe les produits à une température finale supérieure à la température à laquelle la réaction a lieu ; de plus les transferts thermiques vers l'extérieur n'ont pas le temps de s'éffectuer et demeurent négligeables ou nuls. On réalise un cycle thermochimique pour déterminer cette température :
0 = -241,83 103+ D H° primitive de 30,01 + 10,71 10-3 T --> 30,01 T + 5,355 10-3 T² D H° = 30,01 Tf + 5,355 10-3 Tf ² - [30,01 *298 + 5,355 10-3 *298²] = 241,83 103 Tf ² + 5604 Tf - 4,691 107 = 0 d'où Tf = 4598 K. cette température finale est abaissée en présence de dihydrogène en excès ( x mol H2 en excés). même type de calcul en remplaçant Cp(H2O) par :Cp(H2O) + x Cp(H2) et la température finale Tf par 3252 K. 30,01 + 10,71 10-3 T + x [27,28 + 3,26 10-3 T] primitive de cette expression : 30,01 T + 5,355 10-3 T² + x [27,28 T+ 1,63 10-3 T²] les bornes d'intégration sont 298 Ket 3252 K on trouve x = 1 mol. |
||
|
|
||
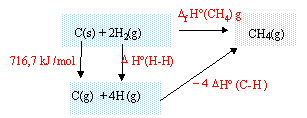
données à 298 K : enthalpie standart de liaisons (kJ/mol) : C-C : 350 ; C-H : 415 ; H-H : 436 ; O=O : 495. enthalpie molaire standart de formation (kJ/mol) : CO2 (g) : -393,5 ; H2O(gaz) : -241,8 ; C(g) : 716,6. capacité calorifique molaire (J K-1 mol-1) : CO2 (g) : 37,1 ; H2O(gaz) : 33,5 ; N2(g) : 29,1 ; CH4(g) : 35,7 ; O2(g) : 29,3 corrigé loi de Hess : Si une réaction chimique se produisant à la température T peut être écrite sous la forme d'une combinaison linéaire de plusieurs équations bilans, l'enthalpie standart de cette réaction est obtenue en faisant une combinaison linéaire des enthalpies de ces réactions en tenant compte des coefficients. Pratiquement on imagine un cycle thermochimique :
l'enthalpie molaire standart de formation du méthane à 298 K est : 716,7 + 2 *
436 - 4*415 = -71,3
kJ/mol.
CH4(g) + 2O2 (g) --> CO2 (g) + 2H2O (g) : D H° comb. l'enthalpie standart de cette réaction : D H° comb = 2 Df H° (H2O) + Df H° (CO2) - Df H° (CH4) - 2 Df H° (O2) l'enthalpie standart de formation d'un corps simple pris son état de référence est nulle : Df H° (O2) =0 D H° comb =
2*(-241,8) + (-393,5) - (-71,3) - 0 =
-805,8
kJ/mol.
l'air contient en mol 20% de dioxygène et 80% de diazote : CH4(g) + 2O2 (g) + 8N2(g) --> CO2 (g) + 2H2O (g) + 8N2(g) On applique la loi de Kirchhoff à un système adiabatique ( pas de transfert de chaleur vers l'extérieur) : la chaleur libérée par la combustion sert à chauffer les produits de la réaction .
total capacité calorifique: 37,1 + 2 *33,5 +8*29,1 = 336,9 J K-1 intégrer entre 298K et Tfinale: 336,9 Tf -336,9*298 = 805,8 103 joules Tf = 2690 K. |