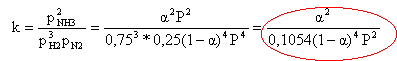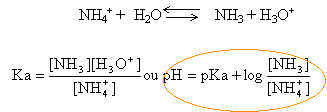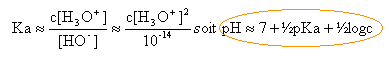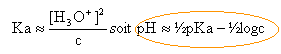|
Capes 62 exercice suivant (comparaison des propriétés de l'eau et de l'ammoniac ) |
||||||||||||
|
||||||||||||
|
corrigé |
||||||||||||
|
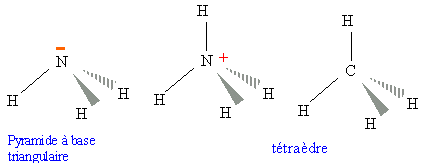
Cet élément compte trois électrons non appariés. Pour compléter sa couche externe à huit électrons( configuration électronique du gaz noble le plus proche, le néon), l'atome d'azote : - pourra acquérir trois électrons et former l'ion nitrure N3-(LiN). - ou pourra former trois liaisons de covalence : exemple NH3. - le doublet non liant peut réaliser une liaison avec un accepteur. - l'atome d'azote peut aussi former des composés intersticiels (FeN) structure électronique du phosphore : 1s2 2s2 2p63s2 3p3 semblable à celle de l'atome d'azote mais l'atome
de phosphore est plus volumineux que l'atome d'azote et il
possède de plus, une couche 3d de valence: les
propriètés du phosphore sont donc assez
différentes de celle de l'azote.
ont le même nombre d'électrons ( molécules isoélectroniques) gaz aux propriétés physiques voisines ( peu solubles dans l'eau, difficilement liquéfiables, très stables ).
NO3-, structure plane, les angles valent 120°, la distance N--O vaut 122 pm (isoélectronique CO32-) l'ammoniac, l'ion ammonium et le méthane ont le même nombre d'électrons
|
||||||||||||
|
équilibre et synthèse de l'ammoniac:
corrigé La variance est donnée par la formule de Gibbs: v = c+2-j. Dans ce cas c= 2 (constituants) et j=1 (une seule phase gazeuse) d'où v=3. Les facteurs
de l'équilibre sont la température, les
pressions partielles des trois gaz : trois facteurs
indépendants. En fixant la température, la
pression totale et l'une des pressions partielle,
l'équilibre est déterminé.
cete relation reste vraie au cours de la synthèse : en conséquence seuls 2 autres facteurs peuvent être fixés arbitrairement (la variance est devenue v=2) pression totale = somme des pressions partielles : P= pH2+ pN2+ pNH3= 4 pN2+ pNH3 or a = pNH3 / P d'où P = 4 pN2+a P pN2=0,25 (1-a)P; pH2 =0,75 (1-a)P. loi d'action de masse :
1,5 10-5 *0,1054 (1-a)4 6002 = a ² 0,569 (1-a)4 = a ² 0,754(1-a)2 = a a²-3,32a+1=0 D=3,32²-4 =7,022 a= (3,32 - 2,65) / 2 = 0,335. La différence avec la valeur expérimentale
vient du fait que l'ammoniac n' est pas un gaz parfait sous
P=600 bars.
pression partielle de l'ammoniac :pNH3=2x / (4-2x) P = x / (2-x) P = aP soit x = 2 a / (1+ a)= 2*0,334 / 1,334 = 0,5 influence de la pression sur la durée de l'établissement de l'équilibre : Lors d'une élévation de pression le nombre de chocs entre molécules augmente par unité de temps et de volume, donc la vitesse des réactions augmente. L'équilibre est plus vite atteint. |
||||||||||||
|
|
||||||||||||
corrigé le doublet électronique libre de l'ammoniac est responsable des propriètés basiques. C'est une base au sens de Brönsted ( espèce susceptible de gagner un proton)
les solutions ammoniacales sont des bases faibles (pKb = 4,75 ou pKa = 9,25) Elles précipitent les hydroxydes insolubles des métaux mais certains se dissolvent par formation d'ions complexes. L'ammoniac en solution donne avec les acides forts des sels. Au voisinage de la demi- équivalence on obtient une solution tampon. L'ammoniac est une base au sens de Lewis : elle peut fournir des électrons à des molécules présentant une lacune électronique. Par exemple avec les trihalogénures de bore, ou d'aluminium, l'ammoniac conduit aux halogénoborammines ou aux halogénoaluminammines.
si [NH3]=[NH4+] alors pH=pKa =9,25 Ka constante de dissociation de l'acide NH4+. pKa + pKb
= 14
à 25°C donc pKb = 4,75.
la concentration d'une solution qui contient 0,01 mol d'ammoniac dans 0,1 L est : c = 0,01 / 0,1 = 0,1 mol /L. conservation de la matière : c = [NH3]+[NH4+]--> [NH3]= c -[NH4+] solution électriquement neutre :(H3O+ minoritaire en milieu basique) [NH4+] = [HO-] --> [NH3]= c -[HO-] voisin de c si on eut négliger [HO-] devant c. repport dans l'expression donnant Ka :
pH voisin de
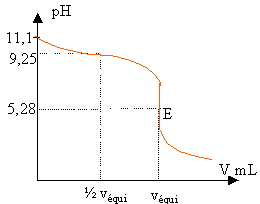
7 +9,25 /2 + 0,5 log 0,1 =11,1.
conservation de la matière : c = [NH3]+[NH4+] (1) la réaction de l'ion NH4+ avec l'eau est très limitée donc [NH4+] voisin de c. NH4+est un acide faible, donc le pH de la solution est inférieur à 7 et les ion HO- sont minoritaires. La solution est électriquement neutre : [Cl-]= [NH4+] + [H3O+] =c (2) (1) et (2) donnent [H3O+] =[NH3] repport dans l'expression de Ka :
pH voisin de
0,5*9,25 -0,5 log 0,05 = 5,28.
La zone de
virage de l'indicateur coloré doit contenir le pH
à l'équivalence: donc le rouge de
méthyle.
A l'équivalence du dosage CaVa = CbVb Cb = 21,6*0,5 / 20 = 0,54 mol/L. la solution commerciale est 20 fois plus concentrée soit : 20*0,54 = 10,8 mol/L. volume gaz ammoniac dissout dans un litre : 22,4*10,8 = 242 L. à partir de la solution commerciale pour obtenir une solution à 0,5 mol/L, le facteur de dilution est : 10,8 /0,5 = 21,6 volume de la solution mère à prélever : 1000 / 21,6 = 46,3 mL - mesurer 46,3 mL de solution mère à l'aide d'une burette de 50 mL - placer un peu d'eau distillée dans une fiole jaugée de 1L - ajouter la
solution mère et compléter avec de l'eau
jusqu'au trait de jauge.
le produit de solubilité de Mg(OH)2 s'écrit : Ks= [Mg2+][HO-]2 = 6 10-12. le pH étant égal à 9,25 : [HO-] = 10-14 / 10-9,25 = 1,78 10-5 mol/L d'où [Mg2+] maxi = 6 10-12 / (1,78 10-5 )² = 1,893 10-2 mol/L ou 0,01893* (24,3 +2*35,5 )= 1,8 g/L. Ce réactif ou "mixture magnésienne" permet de caractériser les ions phosphates PO43- par formation d'un précipité blanc MgNH4PO4, insoluble dans les solutions ammoniacale mais soluble dans les acides. |
||||||||||||
|
retour - menu |