|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||
| .
. |
|||||
|
|||||
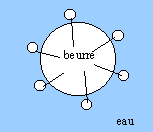
Les ingrédients indispensables pour réaliser une mayonnaise, émulsion stable : huile, eau et un tensioactif ( jaune d'oeuf, lécithine de soja) -------------------O longue chaine carbonée lipophile ; tète hydrophile
Il est difficile de nettoyer correctement un récipient ayant contenu de la mayonnaise avec de l'eau pure : l'eau et les lipides ne sont pas miscibles. Les molécules de tensioactif se collent facilement aux lipides de la mayonnaise par leur queue hydrophobe" Lorsqu'on frotte le récipient, l'huile se décolle de celui-ci et se retrouve entourée de molécules de tensioactif, enfermée dans une micelle qui ne se colle pas au récipient puisque la surface de la micelle est hydrophile".
|
|||||
|
Variations d'une mayonnaise : 7 points Document 1 : les émulsions sont des sources inépuisables de découvertes cyulinaires. Au fil des mois nous avons considérés plusieurs types d'émulsions. La vedette est évidemment tenue par la mayonnaise. Elle s'obtient par dispersion, dans l'eau, de gouttelettes d'huile stabilisée par les protéines du jaune d'oeuf. Première variation : la mayonnaise sans jaune d'oeuf que l'on confectionne comme la mayonnaise classique, mais on remplace le jaune par le blanc. En effet le blanc est constitué par 90% d'eau et 10% de protéines, qui ont les mêmes propriétés tensioactives que les protéines du jaune. En pratique le procédé est exactement le même que la mayonnaise habituelle : dans un bol on ajoute progressivement l'huile et un blanc d'oeuf en fouettant. Au début le blanc mousse, lmais, progressivement, l'huile divisée en gouttelettes de plus en plus petites sous l'action du fouet, remplace l'air qui se trouve dans les bulles. Comme les bulles d'air, les gouttelettes d'huile sont stabilisées par les protéines du blanc d'oeuf, car ces dernières sont déroulées par le cisaillement du fouet, de sorte que leurs parties hydrophobes viennent en contact avec l'huile, les parties hydrophiles des protéines restant dans l'eau. Deuxième variation : la mayonnaise sans oeuf que l'on obtient à partir d'un peu d'eau chauffée, d'une demi feuille de gélatine que l'on dissout, et l'huile que l'on introduit en fouettant, tout comme on fouette une mayonnaise. Dans un premier temps une émulsion blanche apparaît, les protéines apportées par la gélatine venant se placer à l'interface de l'eau et de l'huile autour de chaque gouttelette. Puis, quand cette émulsion repose et refroidit, elle géligie parce que les molécules de gélatine ont tendance à s'associer par leurs extrémités et à former un réseau au sein duquel l'émulsion est piégée. Document 2 : Le principe de la mayonnaise à la gélatine est le suivant : nous avons formé une émulsion qui s'est transformée en gel " physique", c'est à dire un gel qui se défait quand on le chauffe, et de rétablit en se refroidissant.
corrigé on fouette de l'eau et de l'huile dans un bol, on obtient une émulsion instable. on laisse reposer plusieurs minutes le mélange précédent : l'huile et l'eau, liquides non miscibles se séparent en deux couches : l'huile, moins dense, se situant au dessus de l'eau. deux exemples de constituants " tensioactifs" qui assurent cette stabilité : le blanc est constitué par 90% d'eau et 10% de protéines, qui ont les mêmes propriétés tensioactives que les protéines du jaune dans la "mayonnaise sans jaune d'oeuf ", le blanc d'oeuf contient 90 % d'eau ; le lipide est contenu dans les protéines du blanc d'oeuf. hydrophobe : ennemie de l'eau, qui fuit l'eau ( amie des graisses) hydrophile : amie de l'eau, qui fuit les graisses, les lipides. -------------------O longue chaine carbonée lipophile, hydrophobe ; tête hydrophile
les protéines sont enroulées, en fouettant on assure leur déroulement. Il est difficile de nettoyer correctement un récipient ayant contenu de la mayonnaise avec de l'eau pure : l'eau et les lipides ne sont pas miscibles. Les molécules de tensioactif se collent facilement aux lipides de la mayonnaise par leur queue hydrophobe" Lorsqu'on frotte le récipient, l'huile se décolle de celui-ci et se retrouve entourée de molécules de tensioactif, enfermée dans une micelle qui ne se colle pas au récipient puisque la surface de la micelle est hydrophile". Dans le document 2 on lit ... " un gel physique, c'est
à dire un gel qui se défait quand on le
chauffe"... On transpose la phrase à un glaçon
qui subit une transformation physique.
|
|||||
|
|
|||||
|
LiBan Les conserves : aujourd'hui pratiquement toute notre alimentation existe en version "conserve". En France nous en consommons 50 kg par personne et par an. Les principes de l'appertisation ou stérilisation : Pour que les conserves soient sans risques, il est impératif de respecter un certain nombre de principes de fabrication : - Une fraicheur absolue : elle est de rêgle pour les produis destinés à être mis en conserve. Très souvent, les usines sont installées sur les lieux mêmes de production. De la production à la mise en boite, il ne se passe à peine quelques heures. Aussi les conserves sont-elles souvent plus riches envitamines que les légumes frais, vendus deux ou trois jours après leur récolte. - La préparation : une fois lavé, trié, épluché, préparé, cuisiné, le produit à stéréliser est conditionné, le plus souvent dans une boite métallique ; les légumes sont recouverts d'eau salée, les fruits de sirop,les poissons d'huile, de marinade ou de sauce.... Aucun conservateur n'est ajouté. Enfin, pour éviter l'oxydation de la vitamine C, une "désaération" du contenant peut être effectuée avant fermeture. - Le traitement thermique : il détruit la totalité des microorganismes, levures, moisissures, bactéries susceptibles de se développer dans les aliments. Inconvénient : au passage, ces derniers peuvent y perdre en qualités organoleptiques (gôut, consistance, apparence) ainsi qu'en vitamines. C'est pourquoi il est important de trouver la durée et la température de stérilisisation optimales pour chaque aliment.( extrait du hors série 60 millions de consommateurs n°101)
Chimie et lavage : document 1 : c'est au milieu du premier siècle que commencent réellement à être employé le mot savon. Le Gaulois se servaient déja du produit, essentiellement pour les cheveux. Ils combinaient les restes de différentes graisses avec des cendres de bois. Au IVème siècle, le savon obtenu à partir de la potasse et de suif était mou. Plus tard apparu le savon composé d'huile d'olive et de soude ( savon dur) que nous devons probablement aux chimistes arabes. Quant au savon de Marseille il ne date que du XIVème siècle. Son secret de fabrication était jalousement gardé et n'était transmis que de père en fils. En 1790, Nicolas Leblanc démontra que la soude nécessaire à la fabrication du savon pouvait être obtenue à partir du sel. Jusqu'ici elle nécessitait de brûler les plantes chargés de carbonate de sodium. Sa découverte permis l'industrialisation massive du savon qui se rendit peu à peu populaire. Hors série science et avenir avril 1995. 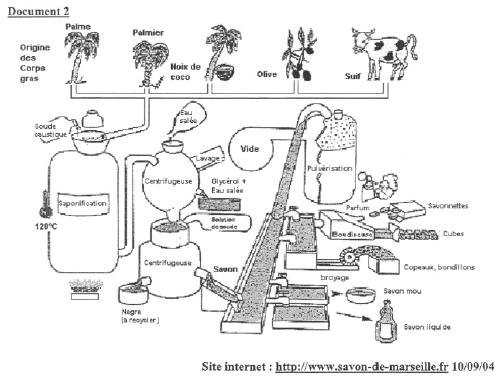
Document 3. Bien qu'ils
soient tous des tensioactifs, chaque détergent a des
propriétés spécifiques. On les regroupe
donc dans deux grandes catégories selon la nature du
groupement hydrophile : les ioniques et les non-ioniques.
Parmi les détergents ioniques on distingue trois
types de tensioactifs : - Les cationiques présentent de faibles propriétés moussantes et détergentes. - Les amphotères dont la particularité est de pouvoir se dissocier en un anion et un cation selon le pH du milieu. Ils sont surtout utilisés pour atténuer les défauts des deux premiers. Hors série Scineces et Avenir avril 1995. document 4 
corrigé au bout de trois jours après sa récolte, la fraicheur d'un légume est altérée : en présence du dioxygène de l'air et de la lumière les aliments subissent une oxydation qui les altère. " De la production à la mise en boite, il ne se passe à peine quelques heures" "les légumes sont recouverts d'eau salée, les fruits de sirop,les poissons d'huile, de marinade ou de sauce". " pour éviter l'oxydation de la vitamine C, une "désaération" du contenant peut être effectuée avant fermeture" le traitement thermique permet de conserver des aliments pendant des années à température ambiante sans utiliser de conservateur. E300 –
E399 : anti-oxydants utilisés pour ralentir le
rancissement des matières grasses.
le carbonate de sodium est le composé qui a permis la fabrication de la soude à partir du 18è siècle. la saponification est la réaction chimique qui conduit à la fabrication d'un savon. rôle de l'eau salée dans la centrifugeuse : le savon est trés peu soluble dans l'eau salée, il précipite sous forme d'un solide. Une huile contient environ 50 % en masse d'oléine. Sachant que 100 g d'oléine sont nécessaires pour obtenir 109 g de savon, calculer la masse d'huile que l'on utilise pour fabriquer une savonnette de 218 g. il faut 200
g d'oléine pour obtenir 218 g de savon ; soit 400 g
d'huile contenant en masse 50%
d'oléine.
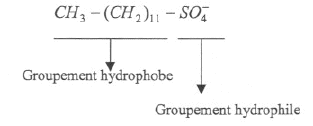
Un savon est peu efficace dans une eau dure : le savon y étant peu soluble. Il faut mettre d'autant plus de savon que l'eau est plus dure. le terme hydrophile : ami de l'eau , qui a une grande affinité pour l'eau. A est un tensioactif de type anionique.( charge négative)
|
|||||
|