|
Bouilloire, autocuiseur, produits d'entretien BTS EFS |
||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
Une bouilloire électrique porte les indications : 220 V et 2200 W. Peut-on la brancher sur une prise de courant pour laquelle l'intensité ne doit pas dépasser 10 A ? intensité (A) = Puissance (W) / tension (V) = 2200/220 = 10 A. Le branchement est donc possible. On suppose qu'il n'y a pas de pertes d'énergie calorifique. Calculer l'énergie nécessaire pour porter de 20°C à 100 0C la température de 1 L d'eau. On fait l'hypothèse que l'eau reste liquide. Masse de 1 L d'eau : m = 1 kg. Capacité thermique massique de l'eau c = 4180 J Kg-1 K-1. Pour élever la température de 1°C, d'une masse de 1 kg d'eau il faut dépenser une énergie de 4180 J. Energie (J) = m (kg) * c * différence de température = 1*4180*(100-20) = 334 400 J. On vous assure qu'il y a intérêt à acheter une bouilloire de puissance 2200 W plutôt qu'une bouilloire de puissance 1100 W, car la durée de fonctionnement, pour un même usage est deux fois plus courte et la dépense en énergie électrique deux fois moins élevée. Critiquer ces propos. Energie = Puissance * Durée de fonctionnement ; Durée de fonctionnement = Energie / Puissance Pour une même dépense énergétique, si la puissance est divisée par 2, la durée de fonctionnement va bien doubler. La dépense énergétique va, par contre, rester la même.
Considérons l'exemple d'un autocuiseur
utilisé dans une cuisine ( 2,8 m x 2,5 m x
2,5 m) où l'air ambiant est à 20
°C, la pression atmosphérique à
1,013 105 Pa ( 760 mm Hg ) et
l'humidité relative égale à
0,6. On fixe le couvercle sur la marmite. Calculer la pression
maximale que pourra atteindre la vapeur d'eau dans
l'appareil compte tenu des caractéristiques
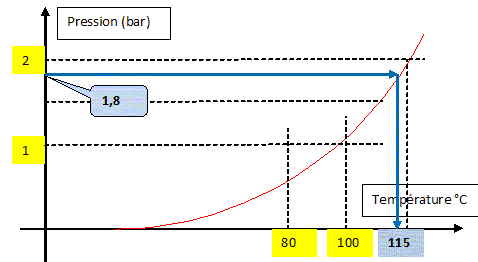
de la soupape. Autocuiseur : masse : 2,2 kg ; masse de la soupape : 51 g ; section de l'orifice d'échappement de la vapeur 6,5 mm2. intensité du champ de pesanteur g = 10 u S.I. Chaleur latente de vaporisation de l'eau à la température d'ébullition L= 2 198 kJ kg-1. Poids de la soupape : P = m g avec m = 51 g = 0,051 kg ; P= 0,051*10 = 0,51 N. La vapeur d'eau, à la surpression p, dans l'autocuiseur exerce une force pressante F, sur la soupape de section S=6,5 mm2 = 6,5 10-6 m2. Force pressante : F = p S = 6,5 10-6 p. La soupape se soulève dès que cette force pressante devient supérieure au poids. 6,5 10-6 p = 0,51 ; p = 0,51/6,5 10-6 = 7,8 104 Pa de plus que la pression atmosphérique extérieure. Pression de la vapeur : 7,8 104 + 1,013 105 =1,8 105 Pa. A l'aide de la courbe de vaporisation de l'eau en déduire la température à laquelle l'eau entrera en ébullition au moment de la mise en rotation de la soupape.
Justifier l'utilisation d'un autocuiseur pour la cuisson des aliments. Cuisson effectuée à température plus élevée, donc plus rapide. Les aliments cuits sont de meilleurs qualité.
L'autocuiseur contenant 1 L d'eau est placé sur une plaque électrique de puissance nominale 1500 W. On conserve cette allure de chauffe après la mise en rotation de la soupape. Calculer la masse d'eau vaporisée en 10 minutes sachant que les pertes sont évaluées à 25 % de la puissance produite. Energie ( J) = puissance (W) * durée (s) = 1500*10*60 =9,0 105 J = 900 kJ. Chaleur latente de vaporisation de l'eau à la température d'ébullition L= 2 198 kJ kg-1. masse d'eau vaporisée : 900/2 198 = 0,41 kg. Calculer la masse de vapeur d'au présente dans la cuisine avant et après l'utilisation de l'autocuiseur. Conclure. Rappel : masse d'un gaz m = a0 d P T0 V / (P0T) avec a0 = 1,3 kg m-3. Volume de la pièce V = 2,8*2,5*2,5 =17,5 m3. L'humidité relative de l'air (ou degré d'hygrométrie), correspond au rapport de la pression partielle de vapeur d'eau contenue dans l'air sur la pression de vapeur saturante à la même température et pression. Pression de vapeur saturante de l'eau à 20 °C : 18 mm Hg = 18*1,013 105 / 760 = 2400 Pa.
avec dans ce cas T = 20+273 = 293 K
Produits d'entretien :
Calculer la concentration molaire de la solution S2 et en déduire le pourcentage massique d'acide sulfmaique dans le détartrant étudié. A l'équivalence les quantités de matière d'acide et de base sont égales. CA VA = CB VB équi ; CA = CB VB équi / VA. CA =0,056*17,2 / 20 =0,04816 mol/L ~0,048 mol/L. Soit n = 0,048*0,1 = 4,8 10-3 mol d'acide sulfamique dans 0,1 L ( 100 mL) d'eau. Masse molaire acide sulfamique (H2N-SO3H) : M =3+14+32+3*16 =97 g/mol masse d'acide sulfamique : m = n M = 4,8 10-3 *97 = 0,466g = 466 mg d'acide dans le comprimé. Pourcentage massique : 466*100/500 = 93%. Que se passerait-il si on utilisait en même temps le déboucheur B et Ouragan ? Quels sont les risques ? L'eau de javel en présence d'un acide fort comme l'acide sulfurique conduit à un dégagement de dichlore, gaz très toxique.
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
|
|