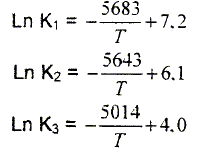|
réduction : élaboration de la poudre de tungstène : concours général 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
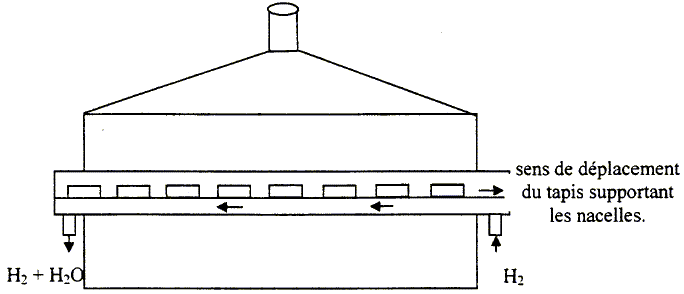
WO3(s) + 3H2(g) = W(s) + 3H2O(g). (a) constante d'équilibre Ka = 1,9. la réduction se fait dans un four électrique dans lequel on observe un double mouvement : le dihydrogène, pur et sec à l'entrée en excès, passe en contre courant sur le trioxyde de tungstène disposé dans des nacelles qui circulent en sens inverse.
Donner une condition sur les quantités de matière de dihydrogène et d'eau pour que la réaction se produise dans le sens direct.
La technique du contre courant permet d'éliminer l'eau et de travailler en continu. En réalité, la réduction se fait selon les trois équations suivantes : W4O11 (s)
+3H2(g) = 4WO2 (s) +
3H2O(g)
(2) WO2 (s) +2H2(g) = W(s)+
2H2O(g)
(3)
Dans le domaine de température 850 - 1300
K, les constantes d'équilibre des
réactions précédentes
dépendent de la température selon les
équations :( T en kelvin) ln K = a -E/(RT) où a est une constante et E l'énergie molaire de la réaction. Calculer les énergies molaires des 3 réactions. R = 8,31 J K-1 mol-1. E1 = 5683 * 8,31 = 4,72 104 J mol-1. E2 = 5643 * 8,31 = 4,69 104 J mol-1. E3 = 5014 * 8,31 = 4,17 104 J mol-1. Ces énergies étant positives, les réactions sont endothermiques : elles seront favorisées par une élévation de température ( apport d'énergie ). Montrer que la réaction (a) peut se mettre sous la forme d'une combinaison linéaire des équations (1), (2), (3). WO3(s) +0,25 H2(g) =0,25 W4O11 (s) + 0,25H2O(g) (1) 0,25 W4O11 (s) +0,75 H2(g) = WO2 (s) + 0,75 H2O(g) (2) WO2 (s) +2 H2(g) = W(s)+ 2 H2O(g) (3) 0,25 (1) +0,25 (2) + (3) donnent : WO3(s) +3 H2(g) = W(s)+ 3 H2O(g) (a). La température est un paramètre important de la fabrication du tungstène comme en témoigne l'expérience suivante : 10 g de poudre fine d'oxyde jaune de trioxyde de tungstène WO3 sont soumis à un courant de dihydrogène sec pendant 1 heure à différentes températures maintenues constantes pendant l'opération. Les résultats sont rassemblés dans le tableau suivant :
Photographies obtenues au microscope :
La température détermine également la taille des particules.
|
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|