|
De la reine des prés à l'aspirine , acide base, ester; électrolyse à anode soluble concours kiné AP HP 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
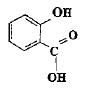
La reine des prés (Filipendula Ulmaria ou spirée) est une plante vivace des zones humides. Sa tige, haute de 50 cm à 1,50 m, est surmontée d'une grappe de fleurs, de couleur crème, au parfum doux. Les fleurs contiennent de l'acide salicylique ou acide spirique (acide 2-hydroxybenzoïque) connu pour ses propriétés inflammatoires et son action apaisante lors de douleurs articulaires. On prépare un volume V d'une solution aqueuse d'acide salicylique de concentration molaire en soluté apporté C = 1,0 10-2 mol.L-1. On mesure le pH de la solution à 25°C : pH = 2,5. Aide au calcul : log (2,5) = 0,4 ; log (1,3) = 0,1 ; 100,5 = 3,2 ; 10-0,5 = 0,32 ; 138*7,25 =100. Ecrire l'équation chimique de la réaction de l'acide salicylique avec l'eau en utilisant les formules semi développées.
Définir puis calculer le taux d'avancement final t de cette réaction. Conclure.
Taux d'avancement final t de cette réaction : t = xf / xmax avec xmax = CV et xf = [H3O+]f V = 10-pH V. t =10-pH / C =10-2,5 / 10-2 = 10-0,5 =0,32 t = 0,32. Le taux d'avancement final étant inférieur à 1, la transformation n'est pas totale. Le couple acide salicylique / ion salicylate
sera noté, pour simplifier
AH/A-. Ka =
[A-]éq
[H3O+]éq
/ [AH]éq Comment nomme-t-on
cette constante d'équilibre ?
Quelle est sa
valeur ? Constante d'acidité. Ka = 10-pKa =
10-3
d'après les données. Cette valeur est-elle
en accord avec le taux d'avancement
final ? [A-]éq =
[H3O+]éq
= t c ;
[AH]éq = (1-t)c Ka =t
2c / (1-t)
=0,322 * 10-2 / (1-0,32) =1,5
10-3 soit pKa = 2,8 écart relatif (3-2,8) / 3 ~ 7 % ( accord
entre la valeur théorique et la valeur
expérimental à 7 % près)
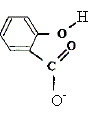
Ecrire l'équation chimique de la réaction entre la solution d'acide salicylique, noté HA(aq), et la solution d'hydroxyde de sodium. HA aq + HO- aq = A-aq + H2O(l). Définir puis calculer la constante d'équilibre de cette réaction. Conclure.
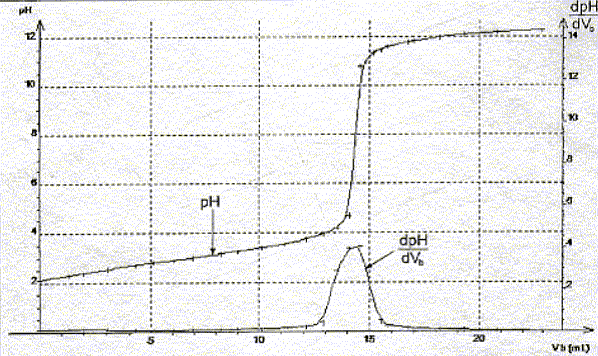
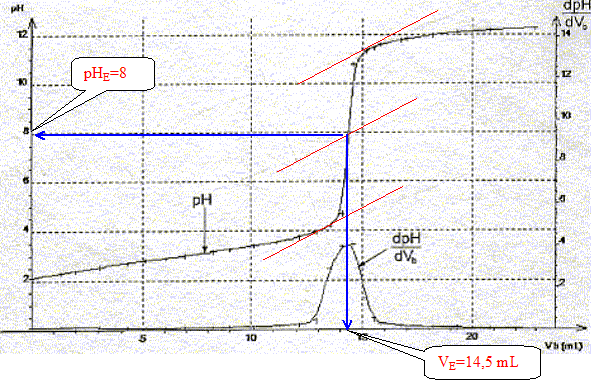
La constante étant très grande la réaction est totale. Utiliser les courbes données pour déterminer les coordonnées du point équivalent.
Définir l'équivalence acido-basique. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence l'acide est en excès ; après l'équivalence la soude, l'autre réactif, est en excès. En déduire la concentration molaire en acide salicylique de la solution diluée puis de la solution pharmaceutique. c vA= cb VE soit c = cb VE / vA=0,10*14,5 / 20 = 7,2 10-2 mol/L La solution pharmaceuthique est 10 fois plus concentrée soit : 7,2 10-1 mol/L. En déduire la masse d'acide salicylique présent dans 100 mL de la solution pharmaceutique. Le résultat est-il en accord avec l'indication de l'étiquette ? n = Cv = 0,72 * 0,1 = 0,072 mol m = n M = 0,072 * 138=9,9 g. L'étiquette indique : 10 g d'acide salicylique pour 100 mL de solution. Ecart relatif :( 10-9,9) / 10 = 0,01 ( 1%) donc accord. Le titrage peut être réalisé plus rapidement en utilisant un indicateur coloré. Choisir, dans la liste proposée ci-dessous, un indicateur convenable, en justifiant la réponse.
donc le rouge de crésol est le plus approprié.
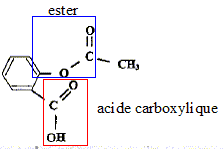
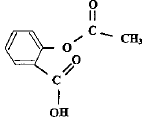
II. De l'acide salicylique à l'aspirine En 1853, le français Charles-Frédéric Gerhardt réalisa l'acétylation de l'acide salicylique en créant l'acide acétylsalicylique plus connu sous le nom commercial aspirine, mais ses travaux tombèrent dans l'oubli. Commercialisée en 1899 par les laboratoires allemands Bayer, à la suite de la découverte par l'allemand Félix Hoffman des propriétés du composé, l'aspirine a depuis de nombreuses indications. Environ 40 000 tonnes de comprimés, achets, gélules, suppositoires sont consommés chaque année. Recopier la formule de l'acide acétylsalicylique, entourer et nommer les groupes caractéristiques présents dans cette molécule.
On peut réaliser la synthèse de l'acide acéthylsalicylique à partir de l'acide salicylique et d'un acide carboxylique. Nommer cet acide. De quelle transformation chimique s'agit-il ? acide éthanoïque ( acétique) ; estérification.
Répondre Vrai ou Faux en justifiant brièvement ( définition, calculs...) Le nickel obtenu à partir du minerai contient des impuretés. On le purifie par électrolyse. l'électrolyte utilisé est une solution de sulfate de nickel Ni2+aq + SO42-aq. l'une des électrodes (A) est une plaque de nickel à purifier. l'autre électrode (B) est une plaque de nickel pur. Pendant l'électrolyse, le nickel contenu dans (A) s'oxyde et les impuretés se dispersent dans la solution électrolytique. le générateur permettant de réaliser l'électrolyse débite un courant d'intensité constante I = 2,0 A pendant 4 heures. On donne : m(Ni) = 58,7 g/mol ; 1 F = 96500 C mol-1 ; 4*36 = 144 ; 96,5*1,5 = 144 ; 1,5 * 58,7 = 88 ; 2,0 *58,7 = 176. A- le nickel impur constitue l'anode. Vrai. A l'anode on observe une oxydation. "Pendant l'électrolyse, le nickel contenu dans (A) s'oxyde" B- La quantité de nickel pur déposé au bout de 4 h est 0,30 mol. Faux. Quantité d'électricité Q = I t = 2,0 * 4*3600 =2,88 104 C Quantité de matière d'électrons : n(e-) =Q/96500 =2*4*36*100 / 96500 = 2*144/965 =2*0,15= 0,30 mol or Ni (s) = Ni2+aq + 2e- d'où n( Ni) = 0,5 nn(e-) = 0,15 mol. C- La concentration des ions nickel augmente au cours de l'électrolyse. Faux. à l'anode : Ni (s) = Ni2+aq + 2e- à la cathode : Ni2+aq + 2e- = Ni (s). D- au bout de 4 h, la masse de nickel déposée est supérieure à 10 g. Faux. m = n (Ni) M(Ni) = 0,15 *58,7 = 8,8 g.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
 (aq)
(aq)